Vector Systems
線虫用遺伝子発現標準プラスミドベクター
概要
C. elegans (線虫)への遺伝子導入は1991年にマイクロインジェクションによって初めて行われました。この技術では汎用プラスミドをC. elegans生殖腺遠位端に注入していました。注入されたDNAは染色体外重複配列(extrachromosomal array)を形成する傾向があり、生殖細胞の核に取り込まれます。この方法は非常に簡単ですが、いくつかの制限があります。一つは、標準プラスミドを導入することで染色体外配列は世代を経ても発現はしますが、一時的(トランジェント)となることです。二つ目に、結果として得られるトランスジェニック動物はモザイクであり、細胞によって導入された遺伝子を持つ者と持たないものがあります。
ベクターシステムの詳細については、下記の文献をご参照ください。
| 参考論文 | トピックス |
|---|---|
| EMBO J. 10:3959 (1991) | DNA transformation in C. elegans |
| Sci Rep. 9:9192 (2019) | Promoter-proximal introns increases gene expression levels in C. elegans. |
特長
当社のベクターはC. elegans で高い遺伝子発現ができるようにバックボーンに合成プロモーター近位イントロンを配置し、最適化しています。
メリット
技術的な容易さ: マイクロインジェクション法によるプラスミドベクターの導入は技術的にわかりやすく、ウイルス生体のパッケージング作業を必要とするウイルスベクターよりも、はるかに容易な技術で行うことができます。
大きなインサート用スペース: 約2.25 kbのプラスミドバックボーンには、インサート用に大きなスペースが用意されており、最大30kbまでのDNAを挿入することができます。
高レベル発現: 合成プロモーター近位イントロンをベクターバックボーンに導入しており、これによってベクターに搭載した遺伝子を非常に高く発現させることが可能です。
デメリット
ベクターDNAがゲノムへ挿入されない: プラスミドベクターによる遺伝子導入法はベクターのほとんどが宿主ゲノムへ挿入されずにエピソームDNAとして維持されるために、ベクターは細胞内で短い期間のみ維持されます。非常に低い頻度ですが、ベクターの宿主ゲノムへ挿入が起こります。薬剤耐性がプラスミドベクターに組み込まれているならば、薬剤選択によって挿入が起こった細胞を選別できます。
細胞タイプの制限: 汎用プラスミドによる遺伝子導入効率は細胞タイプによって大きく異なります。
コピー数のバラツキ: 細胞あたりに導入されるプラスミドベクターの平均コピー数は非常に高くなりますが、ばらつきが大きくなります(ある細胞は非常に高コピー数だが、別の細胞は数コピーしかない、等)。
基本コンポーネント
プロモーター: 目的遺伝子を発現させるためのプロモーターをここに設定して下さい。
合成イントロン: プロモーター近位に配置し、目的の遺伝子発現を促進します。
Kozak: 真核生物における翻訳開始に重要なKozak配列をORF内開始コドンの前に配置します。
ORF: Open Reading Frame. 目的遺伝子のタンパク質コード領域をここに設定して下さい。
3’ UTR+polyA: 転写を終結し、RNAポリメラーゼIIによって生成されたmRNAにポリAを付加します。体細胞と生殖細胞の両方で機能します。
Ampicillin: アンピシリン耐性遺伝子は、アンピシリンによってプラスミド導入大腸菌を選択します。
pUC ori: pUCの複製起点であるpUC oriが挿入されたプラスミドは、大腸菌において高コピー数で保持されます。
実験による検証
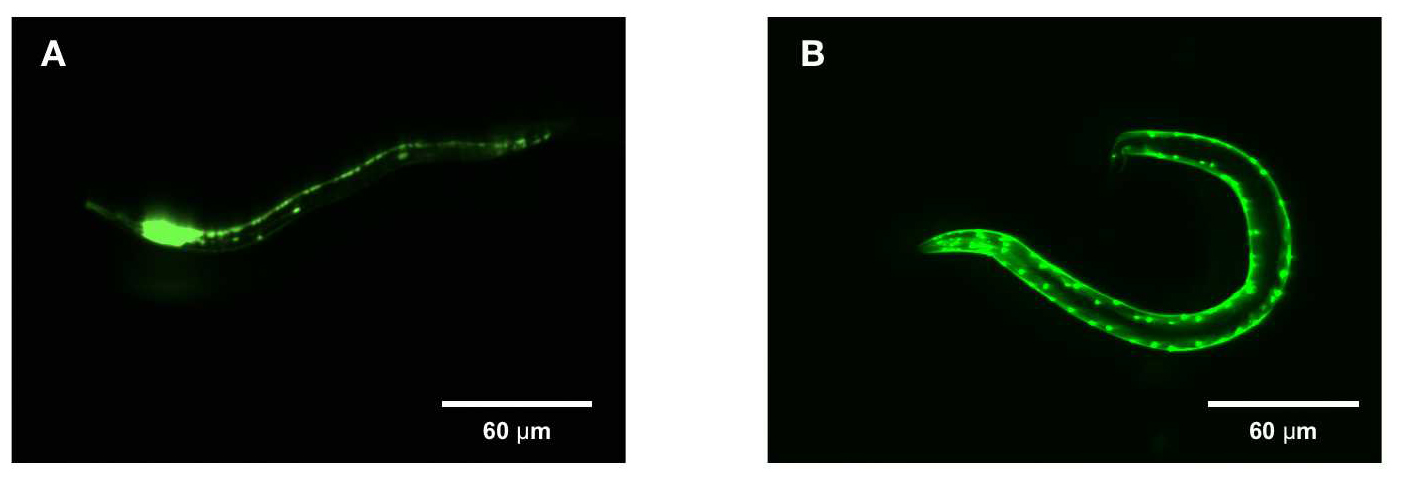
線虫における組織特異的EGFP発現
親線虫(P0、N2株)の生殖腺遠位腕にEGFP発現プラスミド(32ng)とDNAラダー(256ng)をマイクロインジェクションした。孵化後3日目の成体子線虫(P1)において、rab-3およびmyo-2プロモーターで、(A)ニューロン、および(B)筋肉特異的にEGFPを発現させた。頭部は左に位置している。スケールバー=60 um。



