アデノ随伴ウイルス(AAV)作製サービス
組み換えアデノ随伴ウイルス(Adeno associated virus, AAV)は、in vitroおよびin vivoの両系で遺伝子導入に用いることができるため、最も用途が豊富で広範なアプリケーションに使用されているウイルスベクターです。AAVは、多種多様な哺乳動物細胞に形質導入できる特性と、ヒトへの非病原性および低免疫原性から、最も有効な遺伝子治療用ウイルスベクターとして期待されています。
VectorBuilderのAAVパッケージングサービスは、組換えAAVを製造するプロトコールを大幅に改良して独自の技術と試薬を開発し、ウイルスタイター、純度、ウイルス生存率、および均質性に優れたAAVを提供します。そのため、AAVプラスミドベクター構築とAAVウイルスパッケージングの両方をご注文いただくリピーターユーザーが多く、高いユーザーの満足度を誇ります。2022年より、リサーチグレードとGMP-likeの中間にあたるグレードとして ”リサーチ プラス” グレードをご案内しています。リサーチグレードの上位品質で、かつ臨床応用に向けた GMPグレードのAAV製造サービス の前段階として、高度精製と品質検査をオプションでご選択いただけます。これにより当社のAAVウイルス作製サービスは、基礎生命科学研究、創薬ターゲットの探索研究、非臨床研究そして臨床研究へと、一貫したサービスをお届けできる強みを備えています。
ご提供しているアデノ随伴ウイルスの種類
- 1本鎖AAV (single-strand AAV, ssAAV) と 自己相補型AAV (self-complementary AAV, scAAV)
- 多様なセロタイプが選択可能:1, 2, 3, 4, 5, 6, 6.2, 7, 8, 9, rh10, PHP.eB, PHP.S, AAV2-retro, AAV2-QuadYF, AAV2.7m8など
サービスの詳細
VectorBuilderが提供しているリサーチグレードAAVの種類- リサーチグレードAAV(培養細胞用またはin vivo用):弊社のグローバルユーザーからもっとも好まれているAAVパッケージングサービスです。基礎生命科学研究や創薬ターゲット探索研究など、広い用途に対応できるウイルスです。
- リサーチ プラス グレードAAV:クリニカルリサーチャーの方々からのご要望を反映したリサーチグレードの上位品質AAVです。通常の細胞培養施設でウイルスを製造しますが、オプションで精製過程や品質検査を追加したAAVです。
リサーチグレードAAVパッケージング
VectorBuilderのリサーチグレードAAVは、AAV遺伝子送達研究の基礎研究で必要とされるAAVの品質基準を満たしています。ウイルス粒子作製はトリプルトランスフェクション法とバキュロウイルスを使った方法の両方に対応しています。
トリプルトランスフェクションで作製
バキュロウイルスで作製
価格と作成作業日数 プライスマッチ
| スケール | 推奨使用系 | 一般的なタイター | 最小タイター | 容量 | 価格(税別・送料別) | 作業日数 |
|---|---|---|---|---|---|---|
| パイロット | 培養細胞 | >1012 GC/ml |
>2x1011 GC/ml 但しAAV3,4はこの50% |
250 ul (10x25ul) | 70,000円 | 6-12 日 |
| 中容量 | 1ml (10x100ul) | 101,000円 | ||||
| 大容量 | >5x1012 GC/ml |
>2x1012 GC/ml 但しAAV3,4はこの50% |
1ml (10x100ul) | 170,500円 | ||
| 超純粋パイロット | 培養細胞&in vivo | >2x1013 GC/ml |
>1013 GC/ml 但しAAV3,4はこの50% |
100 ul (4x25ul) | 217,000円 | 7-14 日 |
| 超純粋中容量 | 500 ul (10x50ul) | 310,000円 | ||||
| 超純粋大容量 | 1 ml (10x100ul) | 480,500円 | ||||
| 超純粋大容量5 | 培養細胞&in vivo | >2x1013 GC/ml |
>1013 GC/ml 但しAAV3,4はこの50% |
5 ml (10×500ul) | 1,584,000円より | 14-21日 |
| 超純粋大容量10 | 10 ml (10×1 ml) | 2,544,000円より | 21-28日 | |||
| 超純粋大容量10以上 | お問い合わせください | |||||
注:
1. GC=ゲノムコピー
2. AAVセロタイプ 3, 4は他セロタイプと比べてタイターが低くなる傾向があります。そのため、この表に記載されている最小タイターの50%を到達目標タイターとします。
3. 超純粋ウイルスではウイルス粒子を塩化セシウム(CsCl)密度勾配超遠心分離で精製します。
4. 価格は予告なく変更される場合があります。
納品形態
| 培養細胞用AAVウイルス | 超純粋AAVウイルス |
|---|---|
| カスタムAAVウイルス | カスタムAAVウイルス |
|
無料: 標準コントロールウイルス
|
追加購入(オプション): 超純粋標準コントロールウイルス
|
|
メール添付:カルタヘナ法26条1項情報公開書類、品質検査証明書(COA) |
メール添付:カルタヘナ法26条1項情報公開書類、品質検査証明書(COA) |
既製標準コントロールウイルス
既製標準コントロールウイルスとは:カスタムウイルスをご購入いただく場合、 弊社既製品のコントロールウイルスを無料(パイロット、中容量、大容量用)または割引特価(超純粋パイロット、超純粋中容量、超純粋大容量用)でご提供しています。既製標準コントロールウイルスは、感染効率の最適化などの目的に使用していただけるコントロールウイルスです。ご依頼いただいたカスタムベクターのカスタム空ベクターコントロールやカスタムコントロールではありません。厳密な実験用コントロールウイルスではないことをご了承ください(カスタムコントロールは別途デザインとお見積りをいたします。お問合せください。)。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールはEGFPを強制発現するウイルスです。カスタムウイルスがshRNAの発現系では、コントロールはscramble shRNAを発現するウイルスです:
| ベクターシステム | 既製標準コントロールベクター名 | Vector ID |
|---|---|---|
| ssAAV遺伝子発現システム | pAAV[Exp]-CAG>EGFP:WPRE | VB010000-9287ffw |
| scAAV遺伝子発現システム | pscAAV[Exp]-CMV>EGFP | VB010000-9304aud |
| ssAAV U6ベース shRNA ノックダウンシステム | pAAV[shRNA]-CAG>EGFP-U6>Scramble_shRNA | VB010000-9489hhg |
| scAAV U6ベース shRNA ノックダウンシステム | pscAAV[shRNA]-EGFP-U6>Scramble_shRNA | VB010000-9343nhh |
| ssAAV miR30ベース shRNAノックダウンシステム | pAAV[miR30]-CAG>EGFP:Scramble_miR30-shRNA:WPRE | VB010000-9494mnd |
リサーチプラスグレードAAV パッケージング NEW
VectorBuilderのリサーチプラスAAV パッケージングサービスは、リサーチグレードよりもさらに高品質なウイルスです。オプションとして追加精製サービスや品質検査をウイルス製造工程に追加することが可能です。これらリサーチプラスAAVは、夾雑物(ホスト細胞のタンパク質残渣、エンドトキシン、その他)にセンシティブな条件でのAAVの基礎研究用や、特異的な品質規格(例えば、精製法、タイター、バッファー組成などを)を求められるAAV製造に対応します。リサーチプラスはGMP-likeの一歩手前のグレードとみなされ、前臨床動物実験に用いるアッパーグレードのAAVです。
価格と作成作業日数 プライスマッチ
| スケール | 推奨使用系 | 総ウイルス量 (GC) | 価格(税別・送料別) | 作業日数 |
|---|---|---|---|---|
| Research-plus 1 | 様々な in vitro と in vivo 研究用 | 1x1013 | 728,500円より | 10-20 日 |
| Research-plus 5 | 5x1013 | 2,384,000円より | 21-28 日 | |
| Research-plus 10 | 1x1014 | 3,824,000円より |
注:
1. GC = Genome copies.
2. 上の価格と作業日数は、塩化セシウム密度勾配遠心法による精製に基づいています。その他の精製方法(イオジキサノール密度勾配、アフィニティークロマトグラフィー、イオン交換クロマトグラフィーなど)が必要な場合は、お問い合わせください 。
| サイズ |
推奨使用系 | 最小タイター |
容量 | 価格(税別・送料別) | 作業日数 |
|---|---|---|---|---|---|
| 超純粋パイロット | 培養細胞&in vivo | >5x1013 GC/ml | 1 ml (10x100 ul) | 868,000円 | 35-49 日 |
| 超純粋中容量 | 5 ml (25x200 ul) | 3,121,000円 | 35-49 日 | ||
| 超純粋大容量 | 10 ml (50x200 ul) | 5,921,000円 | 35-49 日 |
注:
1. GC = ゲノムコピー
2. バキュロウイルス製造AAVでは次のセロタイプが使えます: AAV1, AAV2, AAV6, AAV8, AAV9.
3. 超純粋ウイルスではウイルス粒子を塩化セシウム(CsCl)密度勾配超遠心分離で精製します。
納品形態
| カスタムAAV |
|
追加購入(オプション): 超純粋標準コントロールウイルス
|
コントロールウイルス
既製標準コントロールウイルスは、感染効率の最適化などの目的に使用していただけるコントロールウイルスです。ご依頼いただいたカスタムベクターのカスタム空ベクターコントロールやカスタムコントロールではありません。厳密な実験用コントロールウイルスではないことをご了承ください(カスタムコントロールは別途デザインとお見積りをいたします。お問合せください。)。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールはEGFPを強制発現するウイルスです:
| ベクターシステム | コントロールベクター名 | コントロールベクター ID |
|---|---|---|
| キメラバキュロウイルス-AAV 遺伝子発現ベクター | pBV/AAV[Exp]-CMV>EGFP | VB200825-1105uwz |
出荷形態と保存方法
当社の培養細胞用AAVはTris組成バッファーに保存され、超純粋AAVはPBS組成バッファーに保存されています。各納品容量に分注した凍結ウイルスをドライアイス梱包で出荷します。お受け取り後は、-80°Cで長期間(1年間)は安定です。-20°Cでは短期間(2〜3週間)の安定した保存が可能です。一旦解凍したAAVウイルスは4°Cで1〜2週間安定して保存できます。 AAVは他の多くのウイルス(レンチウイルスなど)に比べて温度変化に対して寛容なため、ウイルス活性の損失を最小限に抑えて数回凍結解凍が可能です。しかし、実際には凍結融解サイクルの繰り返しはなるべく避けて、融解後の分注チューブは4度で保存し、1〜2週間で使いきってください。
技術的情報
異なるグレード AAVの比較
下の表に研究用に当社が受託製造サービスを提供するAAVの各グレードを比較します。
| 非精製リサーチグレード | 超純粋リサーチグレード | 超純粋プラス グレード | |
|---|---|---|---|
| 対応可能な精製方法 | - | 塩化セシウム密度勾配遠心法 | 塩化セシウム密度勾配遠心法(デフォルト) イオジキサノール密度勾配、アフィニティークロマトグラフィー、イオン交換クロマトグラフィーなど |
| タイター | >1012GC/ml | >1013GC/ml | (1-5)x1013GC/ml |
| 到達可能な純度 (SDS-PAGEにて測定) | - | >80% | >90% |
| 到達可能なエンドトキシンレベル | <30 EU/ml | <10 EU/ml | <2 EU/ml |
| 一般的フルキャプシドの含有比 | - | >70% | >80% |
トリプルトランスフェクションで作製
バキュロウイルスで作製
AAV作製と品質検査
組み換えAAVの製造では、目的の遺伝子(GOI)をクローニングしたトランスファープラスミドを、Rep-capプラスミドおよびアデノウイルス遺伝子(E4、E2A、VA)をコードするヘルパープラスミドとともに、HEK293Tウイルス産生細胞にコトランスフェクトします。短いインキュベーション後、セロタイプ(血清型)に応じて細胞溶解物または上清からウイルス粒子を回収し、PEG沈殿によって濃縮します。超純粋AAV(in vivoグレード)の場合、ウイルス粒子は塩化セシウム(CsCl)密度勾配超遠心分離によってさらに空ベクターの除去と精製および濃縮されます。ウイルスタイターはAAV2ITRシークエンスに対するプライマーを用いてqPCRによってウイルスゲノムコピー数を計測します。
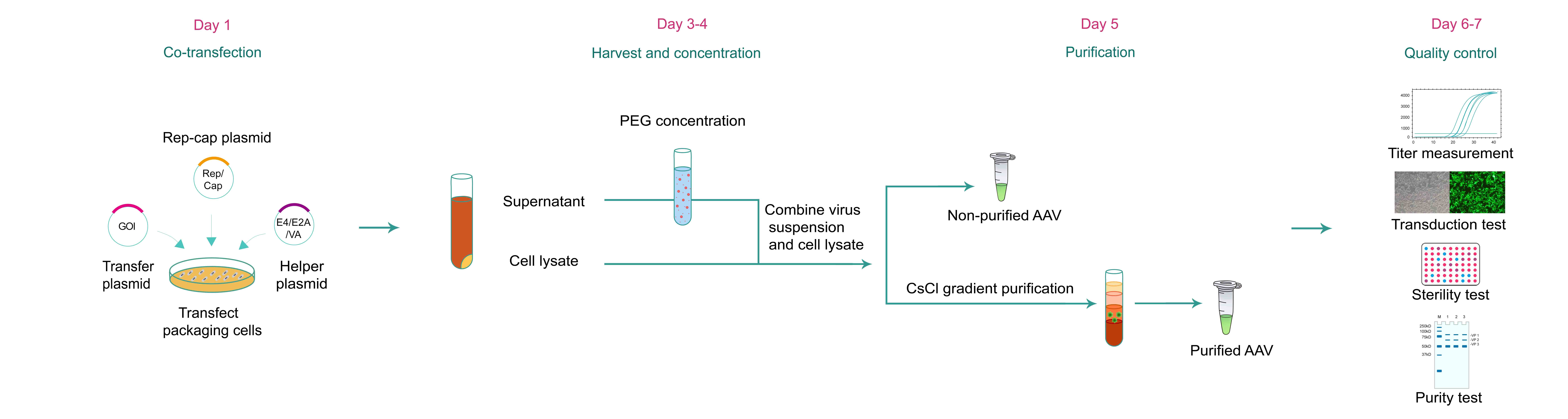
図 1. トリプルトランスフェクションによるAAVパッケージングのワークフロー
VectorBuilderが受託作製した AAVは次の品質検査を行い品質検査証明書を発行します:タイター測定、細菌および真菌の無菌試験、マイコプラズマ検出試験。またトランスファーベクターに蛍光レポーター遺伝子がクローニングされている場合は、HEK293T細胞に受託作製したウイルスを感染させ、感染細胞が蛍光を発現していることを確認します。蛍光レポーター遺伝子がクローニングされていない場合は、薬剤耐性によって感染細胞の生存を確認します。超純粋AAVの場合、SDS-PAGE分析によるAAVキャプシッド(VP1,VP2, VP3)の精製度とウイルス溶液中のエンドトキシンのアッセイを行います。また、個別の研究ニーズを満たすために、より厳格な以下の品質検査サービスも受託しています。
AAV製造と品質検査
バキュロウイルスベースのAAVパッケージングワークフローは、以下の図1に示すように2つの主要なステップで構成されています。ステップ1には、2種類の組み換えバキュロウイルスの作成が含まれます。具体的には、AAV逆方向末端反復(ITR)に隣接する目的の遺伝子(GOI)を発現する最初のバキュロウイルスと、AAVrep遺伝子とcap遺伝子を発現するヘルパーバキュロウイルスです。ステップ2では、ステップ1で作成された2つの組み換えバキュロウイルスを昆虫細胞に同時感染させることにより、組み換えAAV粒子を作成します。
2種類の組み換えバキュロウイルス(一方はAAV ITR内にGOIを発現するウイルス、他方はAAV rep/cap遺伝子を発現するウイルス)を生成するには、まずバキュロウイルストランスファーベクターに各発現カセットをクローニングします。次に、バキュロウイルス導入プラスミドを、Tn7トランスポザーゼを発現するヘルパープラスミドとともに、空のバキュロウイルスシャトルベクター(別名バクミド)を含む細菌宿主に同時形質転換して、組み換えバキュロウイルスを生成します。次に、組み換えバクミドを昆虫のSf9細胞にトランスフェクトします。短期間のインキュベーション後、ウイルス粒子を培地から回収し、ショ糖クッション遠心分離によってさらに濃縮します。バキュロウイルスタイターをqPCRベースアプローチを使用して測定します。次に、両方の組み換えバキュロウイルスを昆虫Sf9細胞に同時感染させます。 約72〜96時間のインキュベーションの後、AAV粒子を細胞溶解物および上清から回収し、PEG沈殿によって濃縮します。超純粋AAV(in vivoグレード)の場合、ウイルス粒子は塩化セシウム(CsCl)勾配超遠心分離によってさらに精製および濃縮されます。AAVのタイターは、qPCRベースアプローチを使用して測定します。
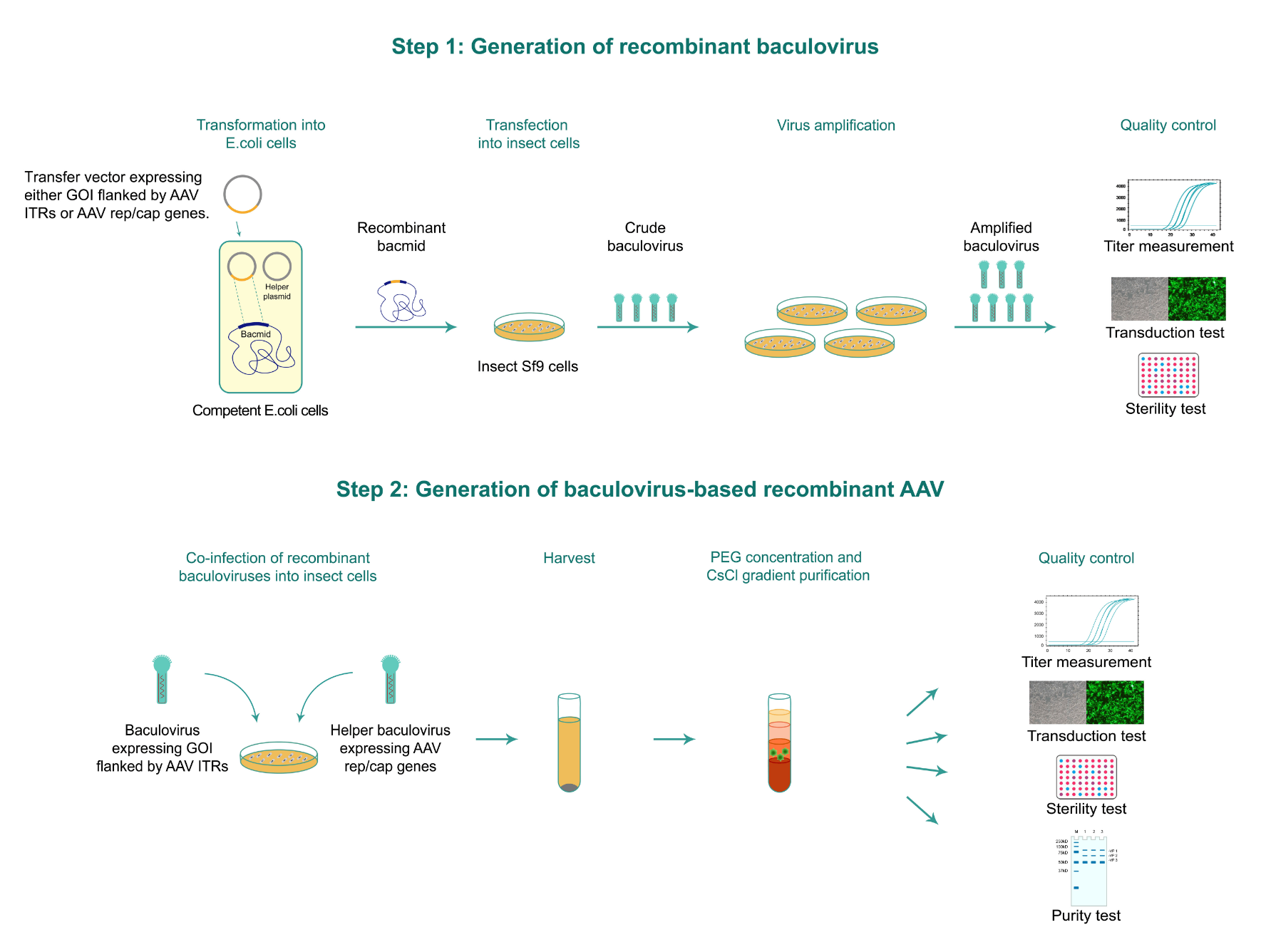
図 1. バキュロウイルスを使用したAAVの大量製造ワークフロー
VectorBuilderが作成した各AAVの品質管理は、タイター測定、細菌と真菌の無菌性テスト、およびマイコプラズマの検出結果を含みます。トランスファーベクターが蛍光タンパク質を発現する場合、HEK293T細胞にウイルスを感染させて、対応する蛍光を検出することで形質導入テストを実行します。さらに、超純粋AAVの場合、SDS-PAGE分析とエンドトキシンアッセイによってウイルスの品質を定期的にサンプリングしています。
| オプショナルQCサービス | 方法 |
|---|---|
| エンドトキシン測定 | LAL |
| タイター測定 | ddPCR |
| TCID50 | |
| AAVの自己複製能テスト | qPCR |
| 空キャプシッド分析 | TEM |
| CDMS | |
| SV-AUC |
AAVセロタイプ(血清型)リスト
セロタイプ別
組織別
| セロタイプ | 組織指向性 |
|---|---|
| AAV1 | Smooth muscle, skeletal muscle, CNS, brain, lung, retina, inner ear, pancreas, heart, liver |
| AAV2 | Smooth muscle, CNS, brain, liver, pancreas, kidney, retina, inner ear, testes |
| AAV3 | Smooth muscle, liver, lung |
| AAV4 | CNS, retina, lung, kidney, heart |
| AAV5 | Smooth muscle, CNS, brain, lung, retina, heart |
| AAV6 | Smooth muscle, heart, lung, pancreas, adipose, liver |
| AAV6.2 | Lung, liver, inner ear |
| AAV7 | Smooth muscle, retina, CNS, brain, liver |
| AAV8 | Smooth muscle, CNS, brain, retina, inner ear, liver, pancreas, heart, kidney, adipose |
| AAV9 | Smooth muscle, skeletal muscle, lung, liver, heart, pancreas, CNS, brain, retina, inner ear, testes, kidney, adipose |
| AAV-rh10 | Smooth muscle, lung, liver, heart, pancreas, CNS, retina, kidney |
| AAV-DJ | Liver, heart, kidney, spleen |
| AAV-DJ/8 | Liver, brain, spleen, kidney |
| AAV-PHP.eB | CNS |
| AAV-PHP.S | PNS |
| AAV2-retro | Spinal nerves |
| AAV2-QuadYF | Endothelial cell, retina |
| AAV2.7m8 | Retina, inner ear |
| 組織 | 推薦する AAV セロタイプ |
|---|---|
| Smooth muscle | AAV1, AAV2, AAV3, AAV5, AAV6, AAV7, AAV8, AAV9, AAV-rh10 |
| Skeletal muscle | AAV1, AAV9 |
| CNS | AAV1, AAV2, AAV4, AAV5, AAV7, AAV8, AAV9, AAV-rh10, AAV-PHP.eB |
| PNS | AAV-PHP.S |
| Brain | AAV1, AAV2, AAV5, AAV7, AAV8, AAV9, AAV-DJ/8 |
| Retina | AAV1, AAV2, AAV4, AAV5, AAV7, AAV8, AAV9, AAV-rh10, AAV2-QuadYF, AAV2.7m8 |
| Inner ear | AAV1, AAV2, AAV6.2, AAV8, AAV9, AAV2.7m8 |
| Lung | AAV1, AAV3, AAV4, AAV5, AAV6, AAV6.2, AAV9, AAV-rh10 |
| Liver | AAV1, AAV2, AAV3, AAV6, AAV6.2, AAV7, AAV8, AAV9, AAV-rh10, AAV-DJ, AAV-DJ/8 |
| Pancreas | AAV1, AAV2, AAV6, AAV8, AAV9, AAV-rh10 |
| Heart | AAV1, AAV4, AAV5, AAV6, AAV8, AAV9, AAV-rh10, AAV-DJ |
| Kidney | AAV2, AAV4, AAV8, AAV9, AAV-rh10, AAV-DJ, AAV-DJ/8 |
| Adipose | AAV6, AAV8, AAV9 |
| Testes | AAV2, AAV9 |
| Spleen | AAV-DJ, AAV-DJ/8 |
| Spinal nerves | AAV2-retro |
| Endothelial cells | AAV2-QuadYF |
* 目的遺伝子を搭載するベクターのITRはAAV2ゲノム由来のシークエンスを使用しています。この表で示しているセロタイプ(血清型)とは、ウイルスキャプシッドタンパク質を指します。他セロタイプのITRをお使いの場合はご相談ください。
メジャーなウイルスキャプシッドタンパク質(VP1)のアミノ酸シークエンスはここから確認できます。>>実験による検証
当社ではバキュロウイルスベースのAAVパッケージングプロトコルを最適化するために独自の技術を数多く開発し、哺乳類細胞で高い形質導入効率を示すことを確認しています。
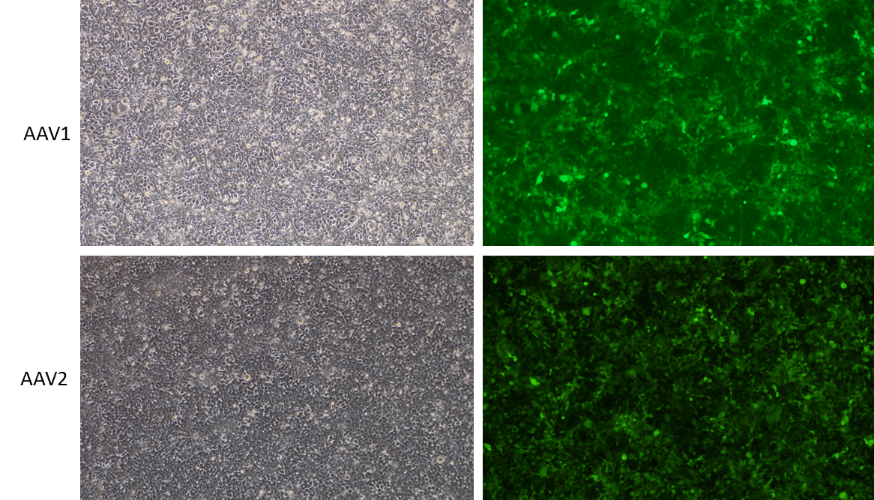
図 2. HEK293T細胞にEGFPを発現するバキュロウイルス-AAV1またはAAV2をMOI 10,000で遺伝子導入した。 倍率: 100x. 左: 明視野細胞像。右:蛍光顕微鏡下によるGFPの緑色蛍光を発現する細胞像。
哺乳動物細胞で当社カスタム製造のウイルスで高い形質導入効率を得られるように、トリプルトランスフェクション用のAAVパッケージング プロトコールを最適化しています。当社独自の技術や試薬を数多く開発してウイルスを作製しています。
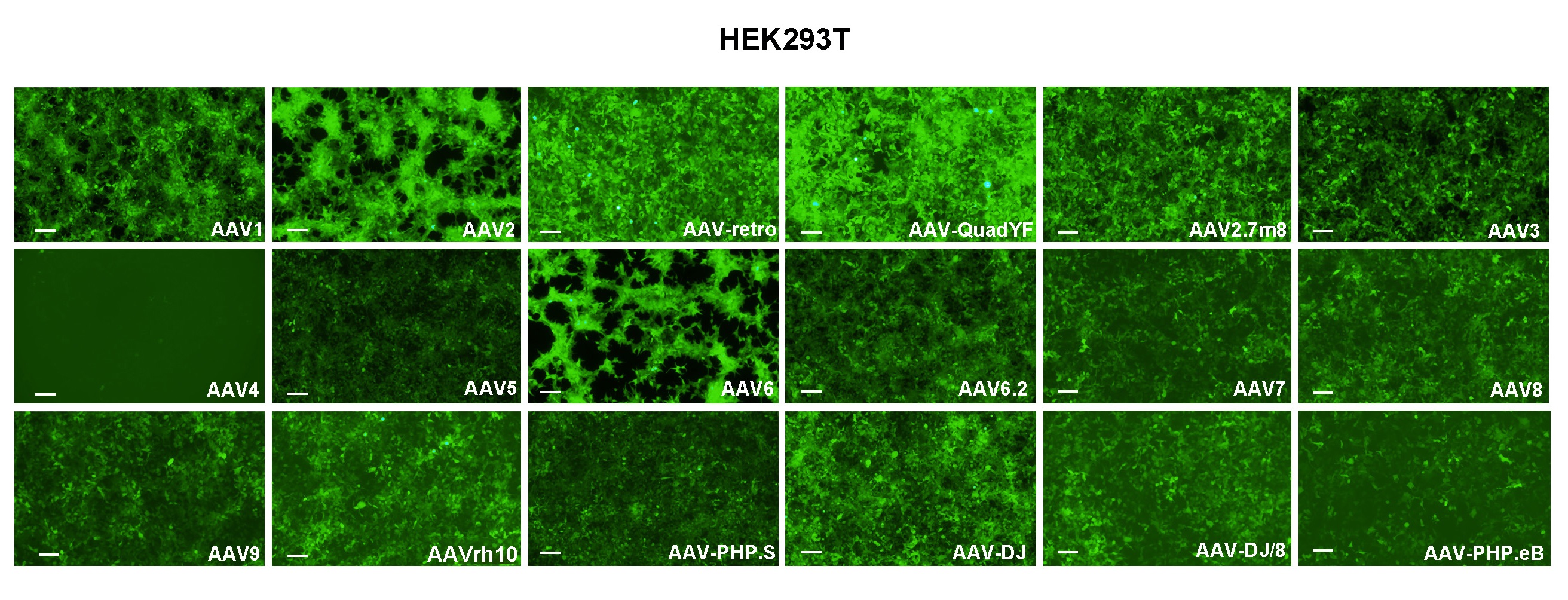
図 2. HEK293T細胞に、18種類の異なるAAVセロタイプキャプシドでパッケージングしたCMV>EGFP vector (VB010000-9394npt)を遺伝子導入した。ウイルス感染から48時間後のEGFP蛍光を異なるセロタイプ間で比較観察した。スケールバー: 100 μm.
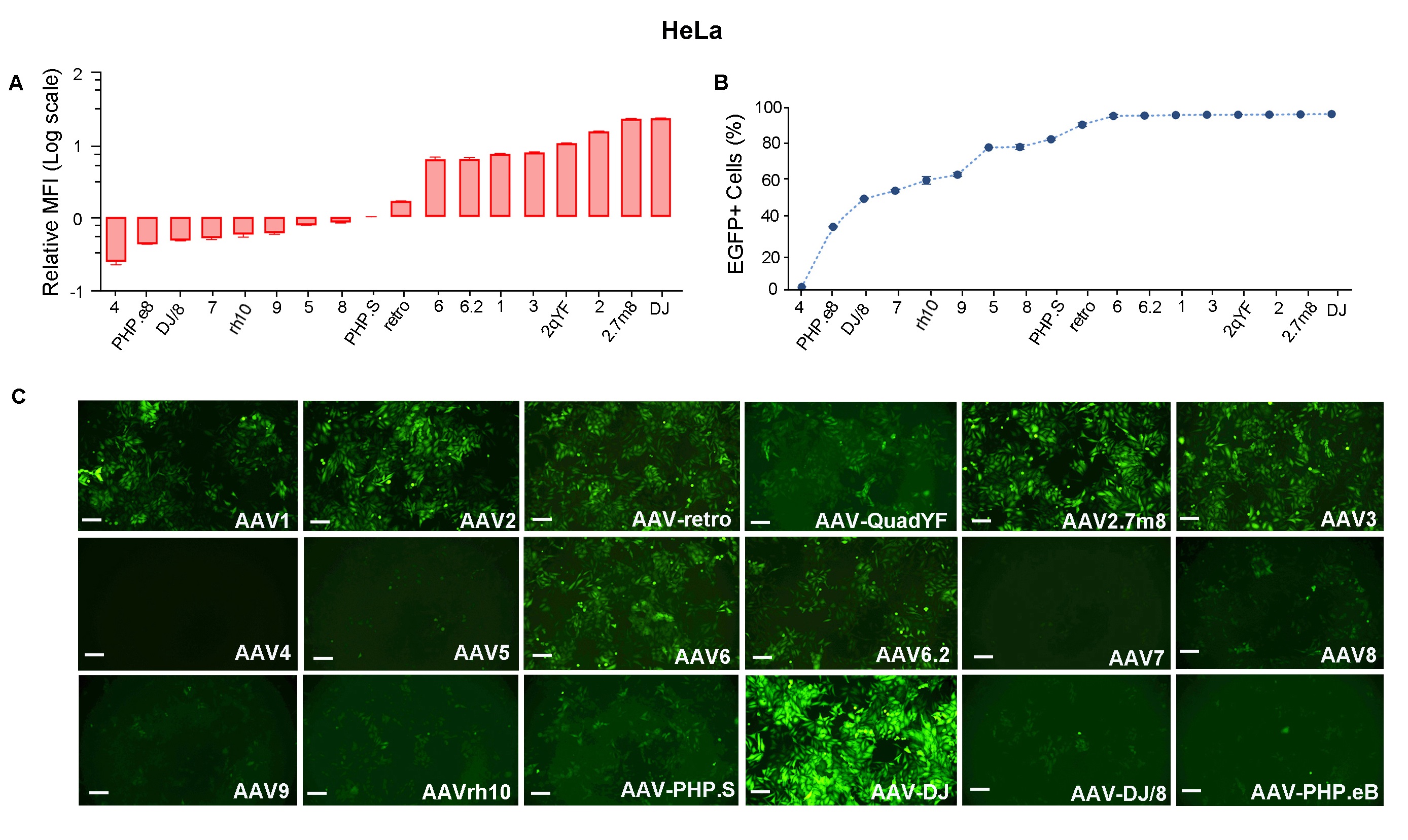
図 3. HeLa細胞に、18種類の異なるAAVセロタイプキャプシドでパッケージングしたCMV>EGFP vector(VB010000-9394npt)を遺伝子導入した。ウイルス感染から48時間後にフローサイトメトリーを使用して、EGFPの(A) 平均蛍光強度 (MFI) および (B) 陽性細胞を定量化した。 (C) EGFP蛍光を異なるセロタイプ間で比較観察した。スケールバー: 100 μm.
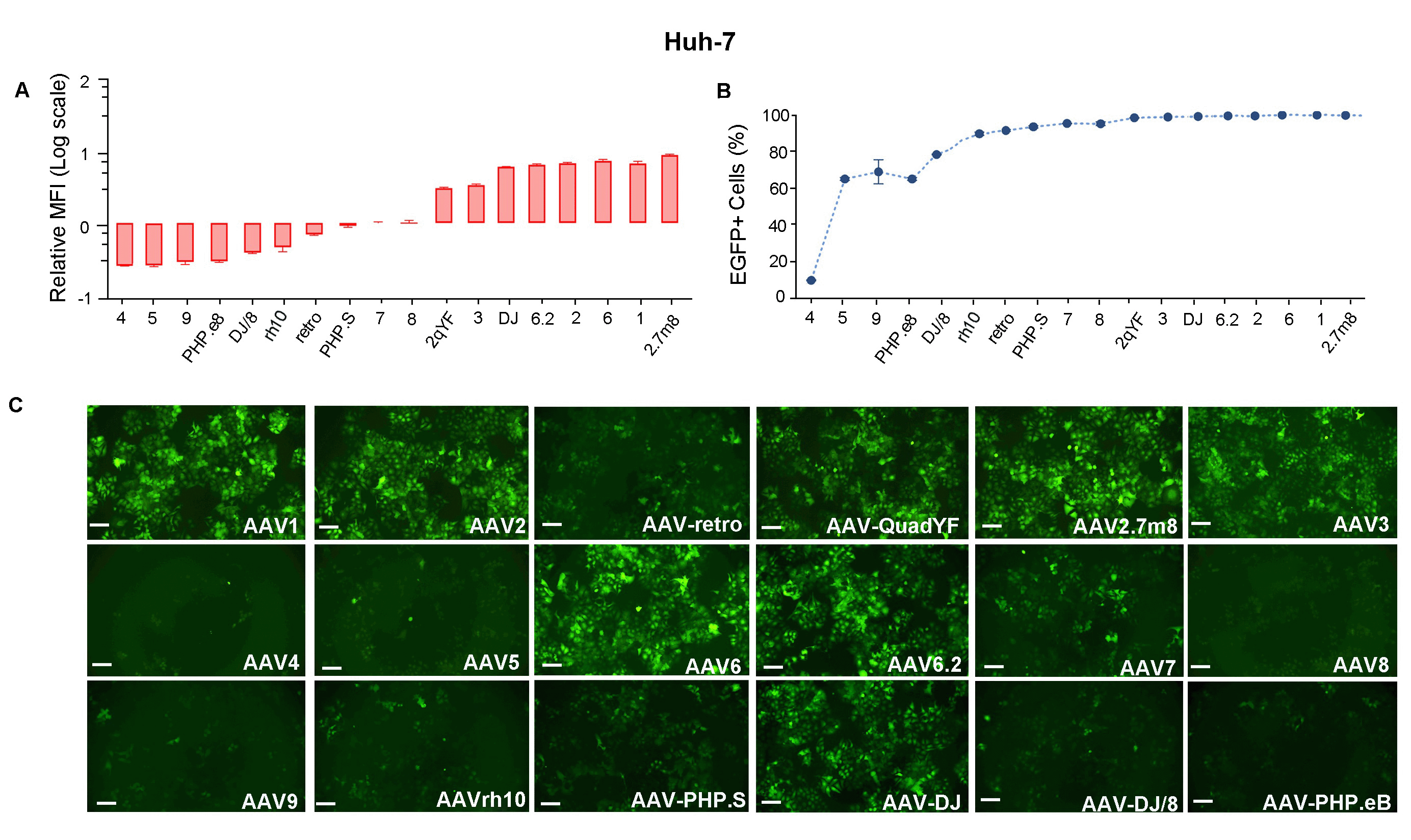
図 4. Huh-7 細胞に、18種類の異なるAAVセロタイプキャプシドでパッケージングしたCMV>EGFP vector (VB010000-9394npt). を遺伝子導入した。ウイルス感染から48時間後にフローサイトメトリーを使用して、EGFPの(A) 平均蛍光強度 (MFI) および (B) 陽性細胞を定量化した。 (C) EGFP蛍光を異なるセロタイプ間で比較観察した。スケールバー: 100 μm.
ご注文方法
ユーザー提供のプラスミドDNAベクターからのウイルスパッケージング
ユーザー提供のAAVウイルスプラスミドをパッケージに使用する場合は マテリアルサブミッションガイドライン に従ってマテリアルを準備し、ベクタービルダー・ジャパン株式会社に発送してください。ユーザーからご提供されるマテリアルはVectorBuilderでお受け取り後、品質検査(QCチェック)に合格することを必須条件としています。QCチェックは、マテリアルごとに16,000円からの追加料金が発生する場合があります。さらにQCチェックに合格するまで、ご依頼の受託サービスが開始することができません。そのため、正しくマテリアルを準備、発送し、プロジェクトが遅延しないよう心がけてください。またユーザーご提供のプラスミドDNAを使ったウイルスパッケージングでは、高タイターを得るには不確定要素が多く、タイター保証に限界があります。そのためタイター保証は不適用とさせていただいています。
リソース
関連技術情報
ユーザーインストラクション 化学物質等安全データシート (MSDS) 品質検査証明書 (Certificate of Analysis, COA) カタログとフライヤーQ&A
| レンチウイルス | MMLV | アデノウイルス | AAV | |
|---|---|---|---|---|
| 組織指向性 | 広範 | 広範 | 数細胞種には不適 | ウイルスセロタイプに依る |
| 非分裂細胞への感染 | 感染する | 感染しない | 感染する | 感染する |
| 安定発現または一過性発現 | ゲノムへの挿入による安定発現 | ゲノムへの挿入による安定発現 | 一過的、エピソーマル | 一過的、エピソーマル |
| 得られる最高タイター | 高い | 中程度 | 高い | 非常に高い |
| プロモーターのカスタマイズ | 可 | 不可 | 可 | 可 |
| 主な使用系 | 培養細胞、 in vivo | 培養細胞、 in vivo | In vivo | In vivo |
| In vivoでの抗原性 | 低い | 低い | 高い | 非常に低い |
標準的なウイルスタイター測定法は、ウイルス粒子からウイルスゲノムを直接抽出し、ITR領域を増幅するqPCRによって、ウイルスゲノムの物理的タイターを正確に定量化しています。オプションとして、他のタイター測定方法(ddPCR、TCID50など)もご提供しています。お見積りの際にお問合せください。
VectorBuilderにて受託構築したpGOIプラスミドベクターを使用するウイルスパッケージングの受託で、かつウイルスにパッケージングされる5’ ITR から3’ ITRの領域の長さが4.7 kb 以下である場合、各セロタイプには到達目標タイターがあります。しかし以下に述べる場合は、到達目標タイターが異なります:
- 5’ ITR から3’ ITRの長さが4.7 kb を超過した場合。ウイルス粒子に組換えウイルスゲノムをパッケージングすることは可能ですが、ウイルスにパッケージされたフラグメント長さに均一性がありません。
- AAVセロタイプ 3, 4, 6, 6.2と2.7m8は、最小タイターの約50%が到達目標タイターです。
- ベクターに搭載されたORFがパッケージング過程に負の営業を及ぼす場合は到達目標タイターはありません:例えば、細胞毒性を持つproapoptotic遺伝子群、膜タンパク質の特長を持つシークエンス、パッケージング細胞またはウイルスの生合成に負の影響を生じる遺伝子、反復シークエンスや高GCリッチシークエンスなど、ベクタークローニングの際にリアレンジメントや二次構造を生じる可能性の高いシークエンスを含むベクターなどです。
- 顧客提供のプラスミドDNAベクターを使った、弊社のウイルスパッケージングの場合到達目標タイターはありません。当社R&Dにおけるウイルス製造の最適化検証が行われていないために不確定要素が多く高タイター製造には限界がああります。
推定作業日数とは、ご注文いただいた受託サービスが弊社で受注され、作製終了し、品質検査に合格し、出荷準備に入るまでの期間を指しています。推定作業日数には、当社製造拠点から出荷ー顧客への納品までの日数は含まれていません。また、ユーザーご提供のプラスミドDNAの受け取り、QCチェックに合格するまでの日数は含まれていません。





