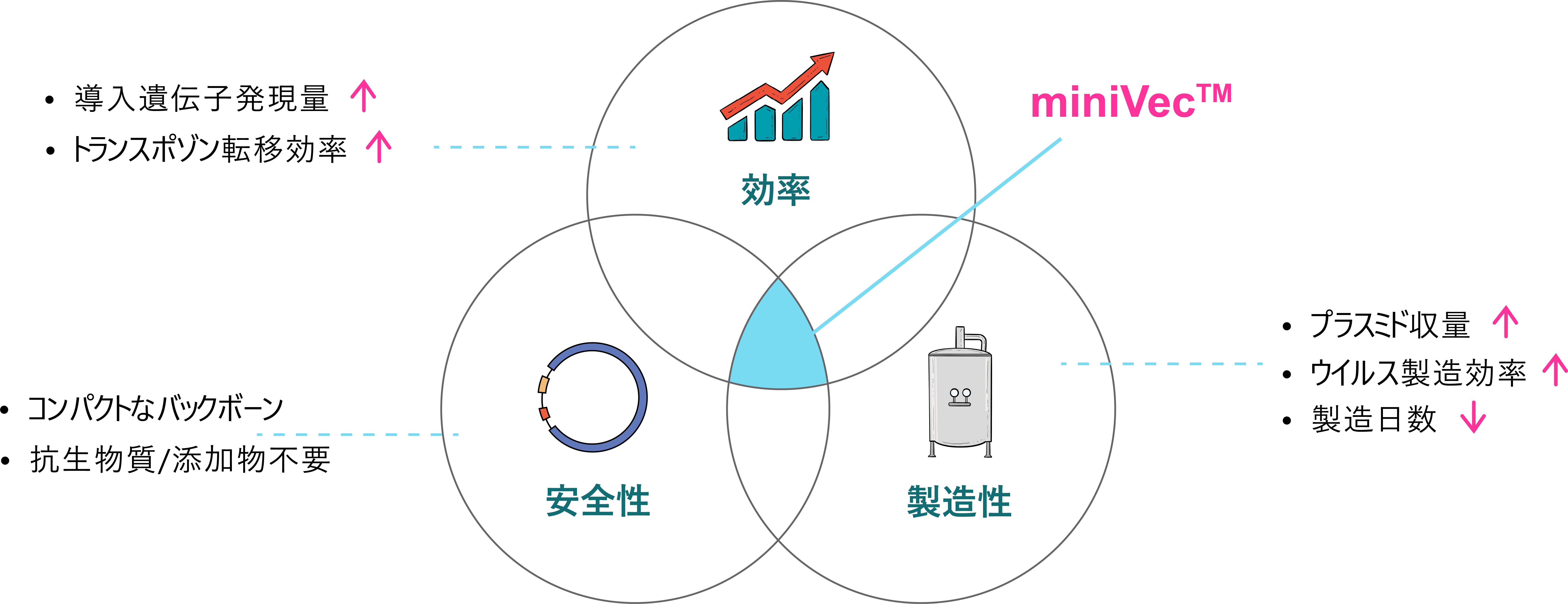
miniVec™ プラスミド

ベクタービルダーの独自開発miniVec™プラスミドは、最小化したプラスミドバックボーンをもち、細胞治療や遺伝子治療に対して明らかな有効性、安全性そして高い製造効率を示します。従来のプラスミドと比較して、miniVec™プラスミドはプラスミド製造量およびウイルスパッケージングの収率が高く、導入遺伝子の発現効率が改善され、安全性プロファイルが強化されています。miniVec™プラスミドは、レンチウイルス、AAV、PiggyBac、Sleeping Beauty、in vitro 転写、および非ウイルス性プラスミドベクターなど、多様なベクターシステムに採用できます。
miniVec™ 技術について
miniVec™システムの概要について図1で説明します。システムの主要コンポーネントとなるminiHost™細胞は、増殖抑制遺伝子が組み込まれた大腸菌株です。miniVec™プラスミドで形質転換されたminiHost™細胞は通常のLB培地で培養可能で、miniVec™プラスミドの制御機構にのみに依存して維持できます。miniVec™バックボーンから転写されるVecSeqB RNAは、成長阻害遺伝子RNAの上流に位置するVecSeqA配列とのRNA-RNA相互作用により、成長阻害剤遺伝子の翻訳を阻害します。その結果、miniHost™細胞は安定的に増殖可能となり、高コピーminiVec™プラスミドを産生します。 このシステムは抗生物質を使用しない選別を可能にすることで、安全性の向上や抗生物質非使用の医薬品製造能力の上昇など様々な利点があります。ベクタービルダーのminiVec™テクノロジーは、卓越した細胞生存メカニズムを持ち、ベクター製造時にLB培地に添加物を追加する必要性を排除しています。
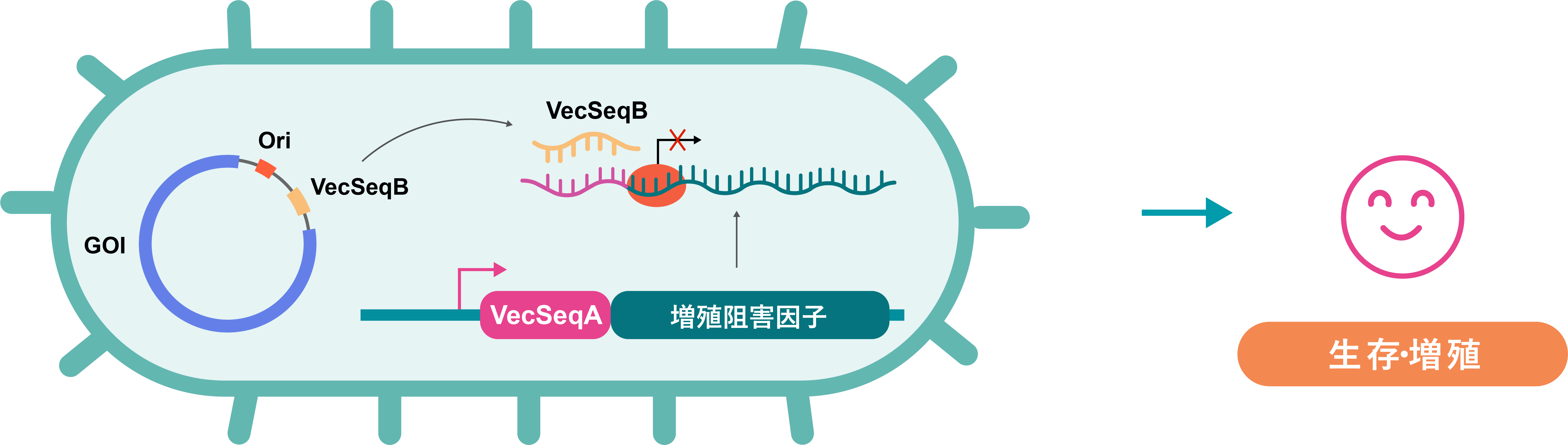
図1. miniVec™プラスミドバックボーンによる細胞選別メカニズム
より高いプラスミド収量
miniVec™プラスミドは、高コピー数のプラスミドを持つ細胞が増殖に有利、より効率的な複製、代謝負担の軽減など、いくつかの重要なメカニズムにより、従来プラスミドと比較して高いプラスミド製造収率を達成できます。
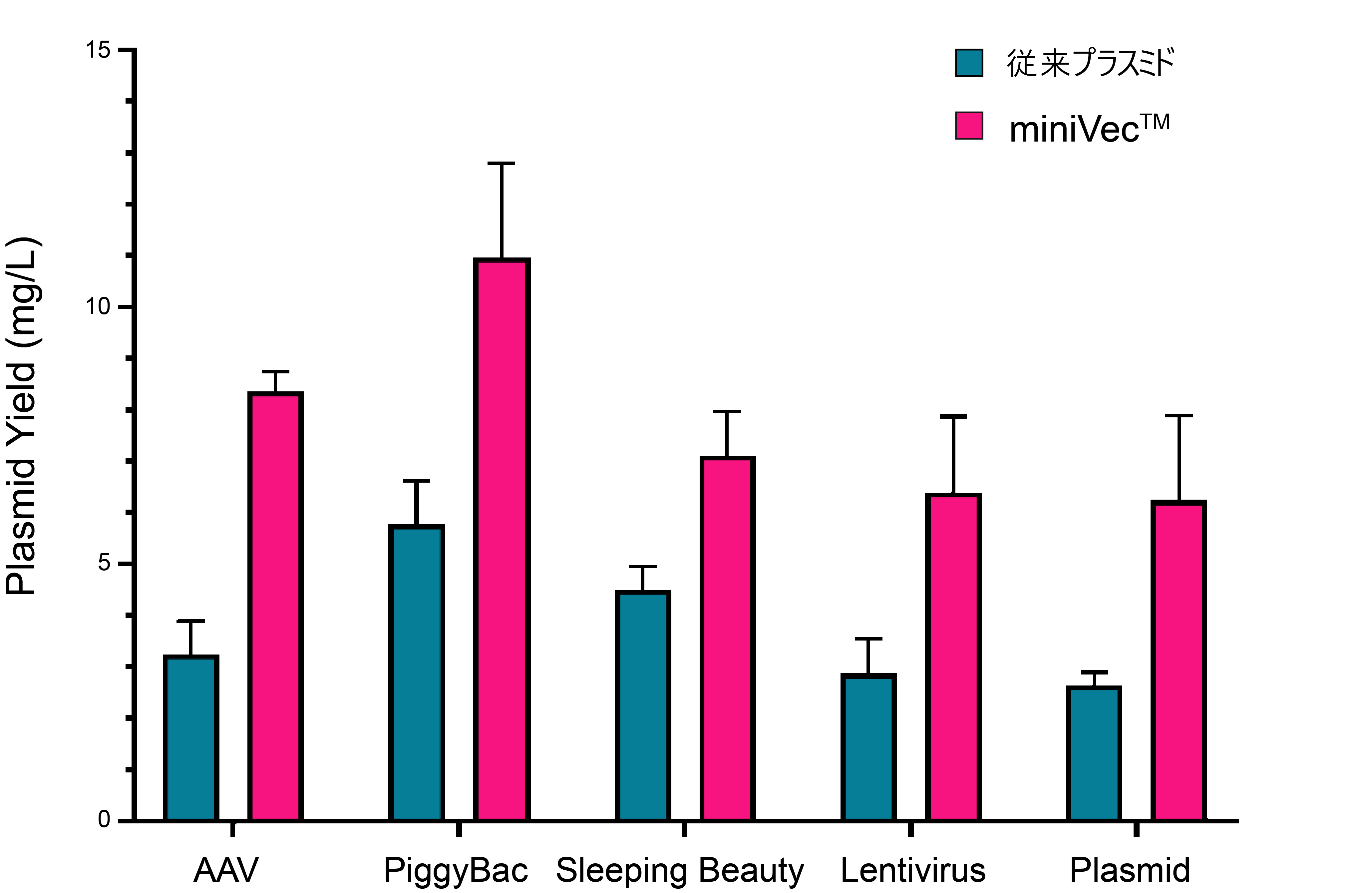
図2. miniVec™は従来プラスミドと比較して高いプラスミド収量を示す。異なるベクターシステムでの従来プラスミドまたはminiVec™プラスミドが形質転換された大腸菌を同じ条件下で培養した場合のプラスミド収量の測定結果。
導入遺伝子発現量の増加
miniVec™プラスミドは、従来プラスミドに比べてin vitroでの導入遺伝子発現が増強されている。バクテリア由来の配列が最小化されたバックボーンは哺乳動物細胞における免疫応答や細胞ストレスのリスクを軽減し、細胞への取り込み量と輸送効率の増加に寄与します。
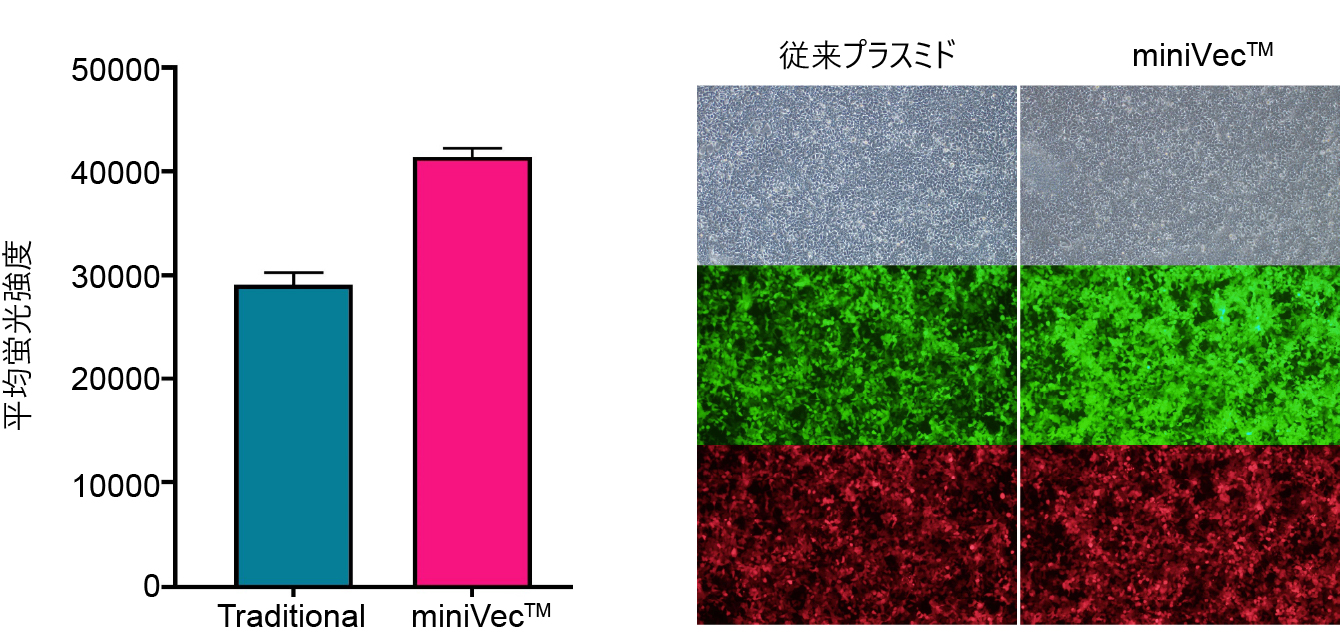
図3. 等モルのminiVec™プラスミドまたは従来プラスミドをHEK293T細胞にトランスフェクションして48時間後、EGFP発現をフローサイトメトリーおよび蛍光顕微鏡で測定すると、従来プラスミドと比較してminiVec™プラスミドのEGFP発現量は増加している。全ての生細胞の測定値から平均蛍光強度 (MFI) を算出した。
さらに、miniVec™プラスミドは従来プラスミドと比較してin vivoでの導入遺伝子の発現が増強されていること確認されています。これらの特徴から、miniVec™は遺伝子治療やDNAワクチンの理想的な選択肢となります。
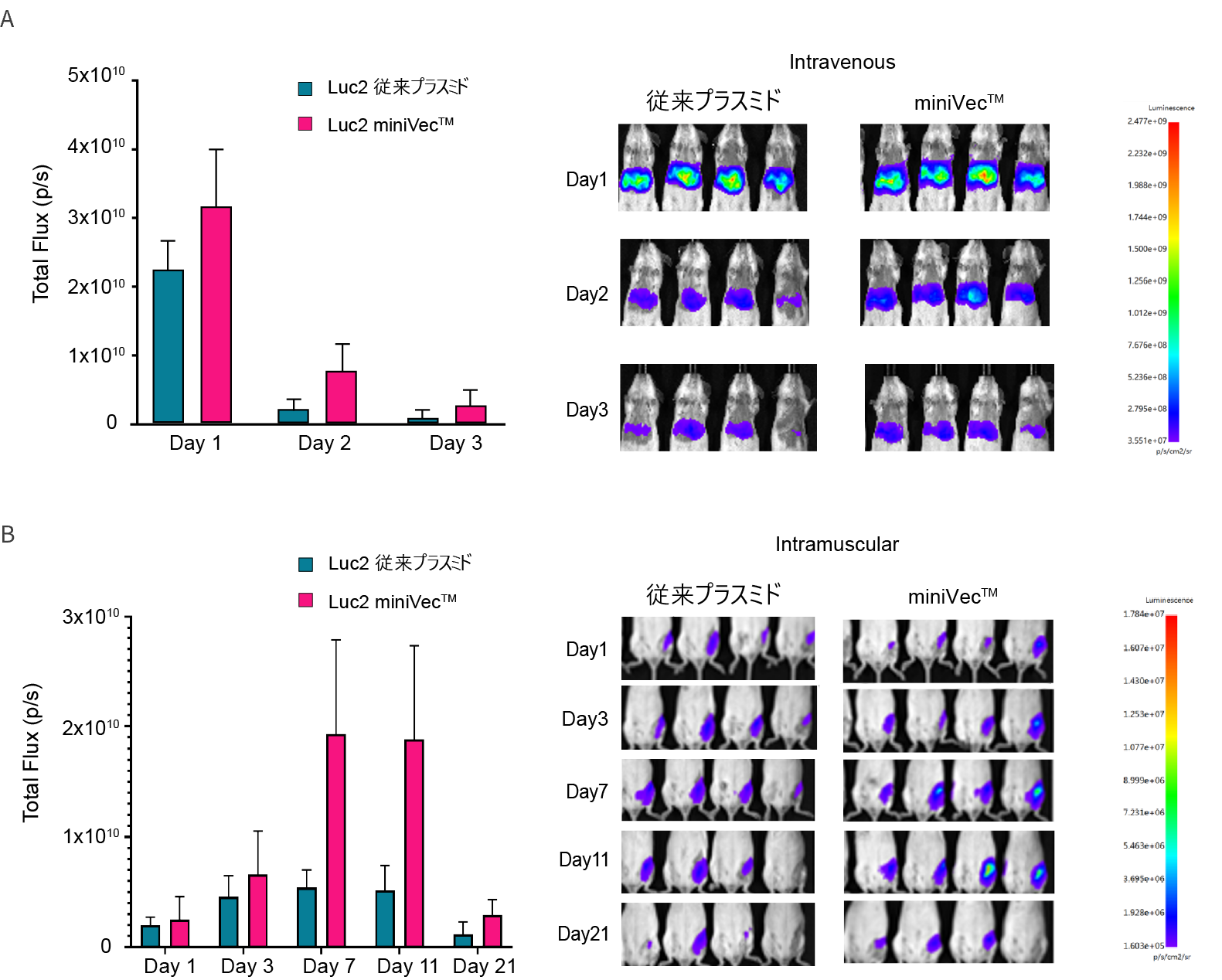
図4. miniVec™プラスミドは従来のプラスミドと比較して、マウスにおけるルシフェラーゼ発現量の増加とより長い発現期間を示した。等モル量のプラスミド(CAG>Luc2)を(A)静脈内または(B)筋肉内に投与している。
高効率なトランスポゾン転移
miniVec™プラスミドは合理的なデザイン、宿主細胞への代謝負担の軽減、安全性の向上により、piggyBacおよびSleeping Beautyトランスポゾンシステムに理想的な選択肢となります。miniVec™プラスミドは細胞内で従来システムと同等かそれ以上のトランスポゾン転移効率を達成します。
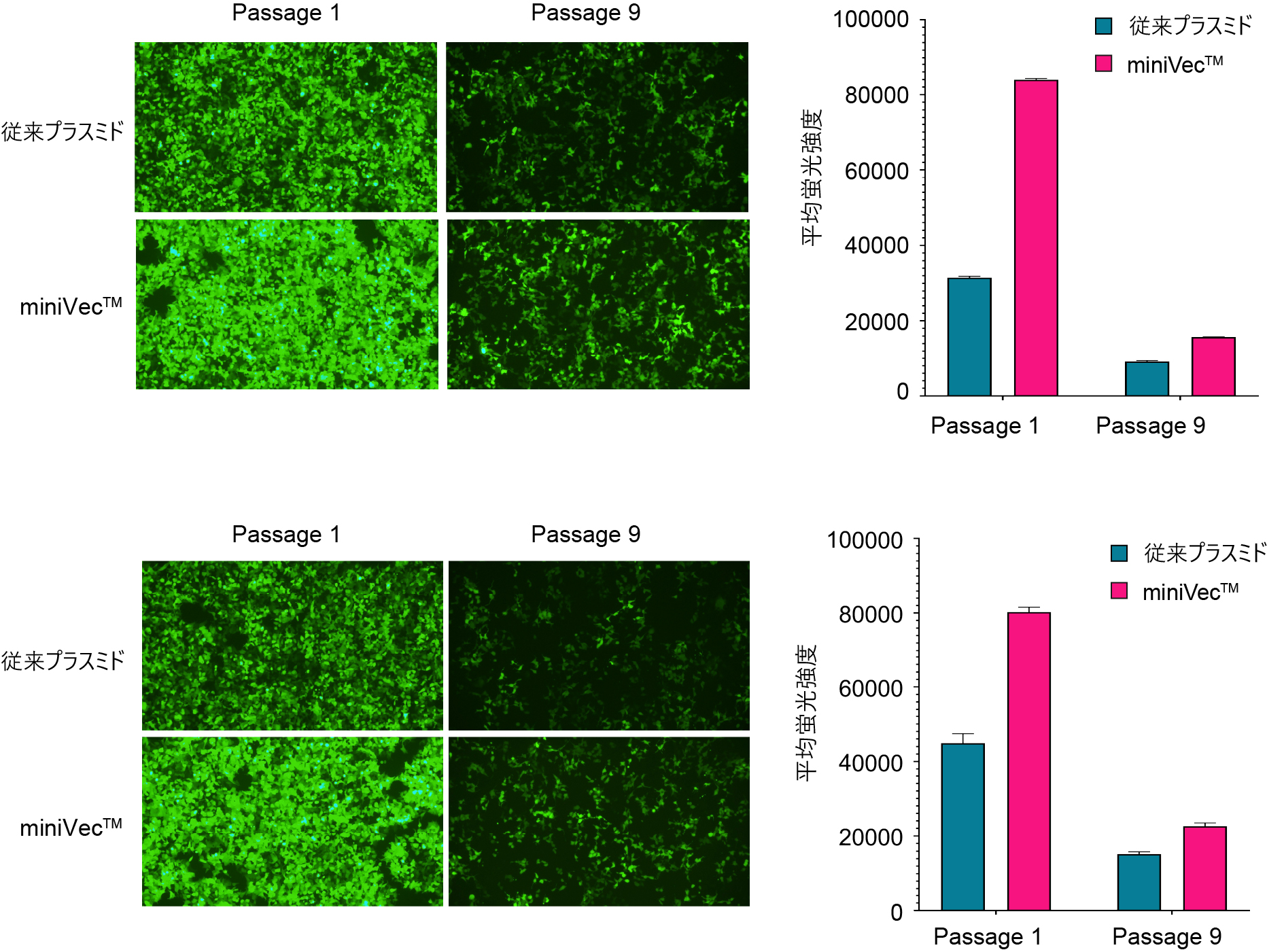
図5. 従来のプラスミドとminiVec™プラスミドを用いた、HEK293T細胞におけるPiggyBacおよびSleeping Beautyシステムの転位効率の比較。測定はフローサイトメトリーによって行われた。全ての生細胞の測定値から平均蛍光強度 (MFI) を算出した。
より安全なウイルスパッケージング用マテリアル
miniVec™プラスミドは、組換えウイルスのGMP製造において、従来の抗生物質が必要なプラスミドよりも安全な選択肢を提供します。最終製品に残留する可能性のある抗生物質のリスクを低減し、かつ遺伝子の水平伝播リスクを軽減します。これにより、GMPプロセスの安全性プロファイルが強化され、規制基準に準拠した最終製品の純度が保証されます。加えて、miniVec™ウイルスパッケージング用プラスミドは、従来のプラスミドよりも高いタイターのウイルスパッケージングを達成できます。
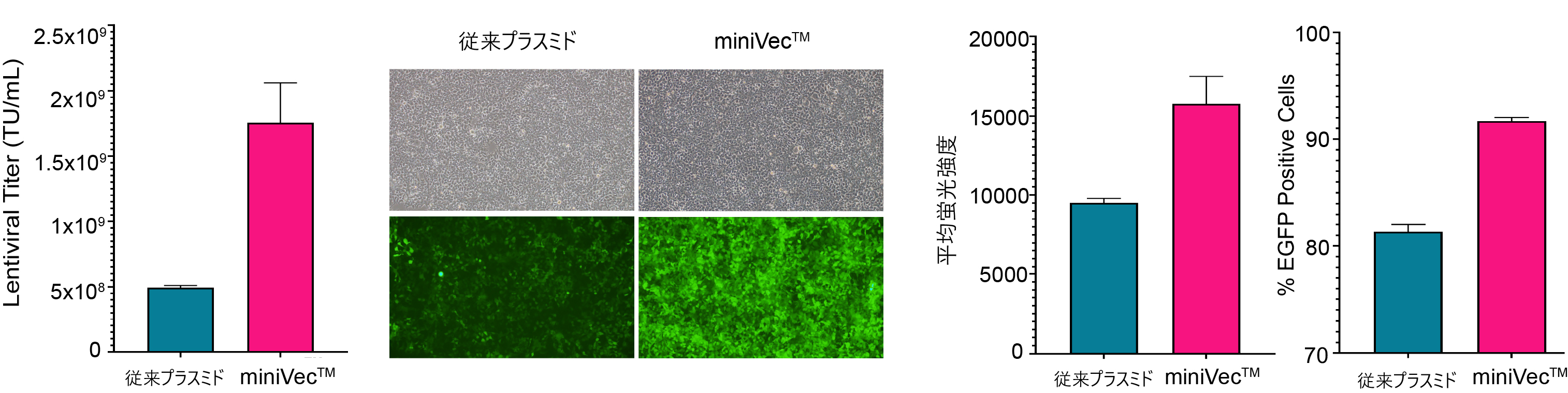
図6. 従来プラスミドとminiVec™プラスミドを用いたレンチウイルスパッケージングの比較。(A)miniVec™プラスミドはより高いレンチウイルスタイターを達成する。機能ウイルスタイターはトランスダクション後にqPCRで測定した。(B) 従来プラスミドとminiVec™プラスミドを用いて作製した等量のレンチウイルスをトランスダクションした細胞におけるEGFP発現量の比較。全ての生細胞の測定値から平均蛍光強度 (MFI) を算出した。




