アデノウイルス作製サービス
組換えアデノウイルスベクターは、多種多様な哺乳動物細胞に対して高い形質導入効率を示し、高レベルの導入遺伝子発現を実現します。アデノウイルスベクターは宿主ゲノムに組み込まれることなくエピソームDNAとして残ります。そのため、in vivoにデリバリーした遺伝子を高レベルで短期間発現させることに適したツールとして、遺伝子治療やワクチン接種によく使用されています。
VectorBuilderのアデノウイルスパッケージングサービスでは独自技術と試薬を開発して組み換えアデノウイルス生産プロトコルを大幅に改善し、タイター、純度、ウイルス生存率、均質性に優れたアデノウイルスを提供しています。その結果、アデノウイルスベクター構築とアデノウイルスのパッケージングサービスを同時注文してくださるユーザーが多く、ユーザーの満足度が高いことが証明されています。
ご提供しているアデノウイルスの種類
- ヒトAd5アデノウイルス
- キメラAd5/F35アデノウイルス
- ガットレスアデノウイルス
アデノウイルス受託作製サービスの詳細
ヒト Ad5 アデノウイルス
キメラ Ad5/F35 アデノウイルス
ガットレスアデノウイルス
価格と作業日数
| スケール | 推奨使用系 | 一般的なタイター | 最小タイター | 容量 | 価格 (税別、送料別) | 作業日数 |
|---|---|---|---|---|---|---|
| パイロット | 培養細胞 | >2x1010 IFU/ml | >1010 IFU/ml | 250 ul (10x25 ul) | 101,000円 | 28-35 日 |
| 中容量 | 1 ml (10x100 ul) | 170,500円 | ||||
| 大容量 | >2x1011 IFU/ml | >1011 IFU/ml | 1 ml (10x100 ul) | 263,500円 | ||
| 超純粋中容量 | 培養細胞 & in vivo | >2x1012 VP/ml | >1012 VP/ml | 500 ul (10x50 ul) | 325,500円 | |
| 超純粋大容量 | 1 ml (10x100 ul) | 387,500円 |
IFU = 感染タイター(Infectious units); VP =ウイルス粒子数 (Virus particles)
価格は予告なく変更される場合があります。
納品形態
| 培養細胞用 | 超純粋 (培養細胞& in vivo) |
|---|---|
| カスタム Ad5 アデノウイルス | カスタム Ad5 アデノウイルス |
|
無料: 標準コントロールウイルス
|
追加購入 (オプション): 超純粋標準コントロールウイルス
|
標準コントロールウイルス
カスタムウイルスをご購入いただく場合、 弊社既製品のコントロールウイルスを無料(パイロット、中容量、大容量用)または割引特価(超純粋大容量用)でご提供しています。既製標準コントロールウイルスは、感染効率の最適化などの目的に使用していただけるコントロールウイルスです。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールはEGFPを強制発現するウイルスです。厳密なカスタムコントロールが必要な場合は別途デザインとお見積りをご依頼ください。コントロールウイルスの詳細を以下に示します:
| ベクターシステム | コントロールベクター名称 | Vector ID |
|---|---|---|
| アデノウイルス遺伝子発現システム | pAV[Exp]-CMV>EGFP | VB010000-9299hac |
| アデノウイルス U6型 shRNA ノックダウンシステム | pAV[shRNA]-EGFP-U6>Scramble_shRNA | VB010000-0020ytx |
| アデノウイルスmiR30型 shRNA ノックダウンシステム | pAV[miR30]-CMV>EGFP:Scramble_miR30-shRNA | VB010000-9350dnk |
| アデノウイルス CRISPRシステム | pAV[Exp]-CMV>EGFP | VB010000-9299hac |
出荷形態と納品後の保存方法
標準アデノウイルスはHBSSバッファーに、超純粋アデノウイルスは GTSバッファーに懸濁されて、各チューブに分注して凍結したものをドライアイス梱包で出荷・納品します。お受け取り後は-80°Cで長期間(1年間)安定です。-20°Cでは短期間(2〜3週間)の安定した保存が可能です。アデノウイルスはレンチウイルスなど他のウイルスに比べて大変安定で、ウイルス活性の損失を最小限に抑えて数回凍結解凍が可能です。しかし、凍結融解サイクルの繰り返しはなるべく避け、融解後の分注チューブは使いきるようにしてください。
価格と作業日数
| スケール | 推奨使用系 | 一般的なタイター | 最小タイター | 容量 | 価格 (税抜き) | 作業日数 |
|---|---|---|---|---|---|---|
| パイロット | 培養細胞 | >2x1010 IFU/ml | >1010 IFU/ml | 250 ul (10x25 ul) | 170,500円 | 35-42 日 |
| 中容量 | 1 ml (10x100 ul) | 263,500円 | ||||
| 大容量 | >2x1011 IFU/ml | >1011 IFU/ml | 1 ml (10x100 ul) | 403,000円 | ||
| 超純粋中容量 | 培養細胞 & in vivo | >2x1012 VP/ml | >1012 VP/ml | 500 ul (10x50 ul) | 496,000円 | |
| 超純粋大容量 | 1 ml (10x100 ul) | 589,000円 |
IFU = 感染タイター (Infectious units); VP =ウイルス粒子数 (Virus particles)
価格は予告なく変更される場合があります。
納品形態
| 培養細胞用 | 超純粋(培養細胞&in vivo) |
|---|---|
| カスタムキメラ Ad5/F35 アデノウイルス | カスタムキメラ Ad5/F35 アデノウイルス |
|
無料: 標準コントロールウイルス
|
追加購入 (オプション): 超純粋標準コントロールウイルス
|
標準コントロールウイルスについて
コントロール Ad5/F35 アデノウイルスベクターは、Ad5/F35 アデノウイルスの感染効率の最適化などの目的に使用していただけるコントロールウイルスです。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールウイルスはEGFPを過剰発現するコントロール Ad5/F35 アデノウイルスです。厳密なカスタムコントロールが必要な場合は別途デザインとお見積りをご依頼ください。コントロールウイルスの詳細を以下に示します:
| ベクターシステム | コントロールベクター名称 | Vector ID |
|---|---|---|
| Ad5/F35アデノウイルス遺伝子発現システム | pAd5/F35[Exp]-CMV>EGFP | VB010000-9301bcw |
出荷形態と納品後の保存方法
標準アデノウイルスはHBSSバッファーに、超純粋アデノウイルスは GTSバッファーに懸濁されて、各チューブに分注して凍結したものをドライアイス梱包で出荷・納品します。お受け取り後は-80°Cで長期間(1年間)安定です。-20°Cでは短期間(2〜3週間)の安定した保存が可能です。アデノウイルスはレンチウイルスなど他のウイルスに比べて大変安定で、ウイルス活性の損失を最小限に抑えて数回凍結解凍が可能です。しかし、凍結融解サイクルの繰り返しはなるべく避け、融解後の分注チューブは使いきるようにしてください。
価格と作業日数
| スケール | 推奨使用系 | 最小タイター | 容量 | 価格 (税抜き) | 作業日数 |
|---|---|---|---|---|---|
| 超純粋中容量 | 培養細胞 & in vivo | >1011 VP/ml | 10x50 ul | 620,000円 | 44-62 日 |
| 超純粋大容量 | 培養細胞 & in vivo | >1011 VP/ml | 10x100 ul | 775,000円 | 44-62 日 |
VP = ウイルス粒子数(Virus particles)
納品形態
| カスタムガットレスアデノウイルス |
|
追加購入 (オプション): 超純粋標準コントロールウイルス
|
標準コントロールウイルスについて
既製標準コントロールウイルスは、感染効率の最適化などの目的に使用していただけるコントロールウイルスです。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールはEGFPを強制発現するウイルスです。厳密なカスタムコントロールが必要な場合は別途デザインとお見積りをご依頼ください。コントロールウイルスの詳細を以下に示します:
| ベクターシステム | コントロールベクター名称 | Vector ID |
|---|---|---|
| ガットレスアデノウイルス遺伝子発現システム | pGLAd_Exp[Exp]-CMV>EGFP | VB010000-9400ggg |
出荷形態と納品後の保存方法
標準アデノウイルスはHBSSバッファーに、超純粋アデノウイルスは GTSバッファーに懸濁されて、各チューブに分注して凍結したものをドライアイス梱包で出荷・納品します。お受け取り後は-80°Cで長期間(1年間)安定です。-20°Cでは短期間(2〜3週間)の安定した保存が可能です。アデノウイルスはレンチウイルスなど他のウイルスに比べて大変安定で、ウイルス活性の損失を最小限に抑えて数回凍結解凍が可能です。しかし、凍結融解サイクルの繰り返しはなるべく避け、融解後の分注チューブは使いきるようにしてください。
技術的情報
ヒト Ad5 アデノウイルス
キメラ Ad5/F35 アデノウイルス
ガットレスアデノウイルス
アデノウイルス作製と品質検査
アデノウイルスの製造では、まず目的の遺伝子(GOI)がクローニングされたアデノウイルスベクターをPacI制限酵素処理によってリニア化(線状化)します。リニア化したベクターDNAを、アデノウイルス遺伝子E1を発現するパッケージング細胞にトランスフェクトして、組み換えアデノウイルスを生成し、細胞培養培地に放出されたアデノウイルス粒子を収集します。 超純粋アデノウイルス(in vivoグレード)の場合、ウイルス粒子は塩化セシウム(CsCl)勾配超遠心分離によってさらに精製および濃縮されます。免疫細胞学的にアデノウイルス特異的ヘキソンタンパク質を検出しウイルスタイターを測定します。超純粋グレードのアデノウイルスでは、ウイルス粒子の光学密度(OD260を使用)を測定してタイターを推定します。
VectorBuilderが製造する各アデノウイルスの品質管理には、タイター測定、細菌や真菌の無菌性試験、マイコプラズマ検出試験が含まれます。アデノウイルスベクターが蛍光タンパク質をコードしている場合は、形質導入試験を行って、目的の蛍光が発現することを確認します。さらに、超純粋アデノウイルスの場合、定期的にエンドトキシンアッセイを行って、エンドトキシンレベルをチェックしています。COAへエンドトキシンアッセイ結果の記載するためには追加費用が発生します。ご希望の追加QCにも対応可能です。
キメラ Ad5/F35アデノウイルス作製と品質検査
下の (図1)に示すように、キメラAd5 / F35アデノウイルス製造では、まず目的の遺伝子(GOI)を運ぶAd5 / F35アデノウイルスプラスミドDNAベクターを、制限酵素PacIでリニア(線状)化します。リニア化されたベクターDNAは、アデノウイルス遺伝子E1を発現するパッケージング細胞にトランスフェクトされて組み換えアデノウイルスを産生ます。アデノウイルス粒子は組織培養培地に放出され、回収します。 超純粋Ad5 / F35アデノウイルス(in vivoグレード)の場合、ウイルス粒子はさらに精製され、塩化セシウム(CsCl)勾配超遠心分離によって濃縮されます。培養細胞グレード(in vitroグレード)のウイルスは、免疫細胞化学的手法でアデノウイルス特異的ヘキソンタンパク質を検出し測定することで、ウイルスのタイターを求めます。超純粋Ad5 / F35アデノウイルスの場合は、ウイルス粒子の光学密度(OD260を使用)を測定してタイターを求めます。
図 1. キメラAd5/F35アデノウイルスパッケージングの一般的なワークフロー
VectorBuilderで作製した各アデノウイルスの品質管理には、タイター測定、細菌と真菌の無菌性テスト、およびマイコプラズマの検出によるデータが提供されます。そして Ad5 / F35アデノウイルスプラスミドDNAベクターが蛍光タンパク質マーカーをクローニングしている場合、作成したウイルスを培養細胞に感染させ、対応する蛍光マーカーの形質導入データを含みます。さらに、超純粋アデノウイルスは、エンドトキシンアッセイを定期的に実施して各ウイルスのエンドトキシンレベルをチェックしています。
Ad5アデノウイルス vs. キメラAd5/F35アデノウイルス
最もよく使用されているヒトアデノウイルス血清型5(Ad5)ベクターは、標的細胞に感染するためのコクサッキーおよびアデノウイルス受容体(CAR)を必要とすることがリミッティングファクターとなっています。 CARが発現していない、またCAR発現量が低い宿主細胞は、Ad5で効率的な形質導入が望めません。そこで、キメラAd5 / F35ウイルスが役にたちます。このウイルスベクターでは、アデノウイルス血清型35(Ad35)に由来するノブとシャフト、およびAd5に由来するファイバーテールで構成されるキメラファイバータンパク質を発現させ、Ad35ファイバータンパク質が標的に付着する能力を利用しています。そのためキメラAd5 / F35アデノウイルスでは、CARネガティブ細胞または低レベルCAR発現細胞に対しても、非CAR受容体であるCD46を介して容易に形質導入が行えます。Ad5 / F35アデノウイルスのキメラ化によって、アデノウイルスベクターの組織指向性が、造血細胞、原始幹細胞、血管平滑筋細胞、CARネガティブ腫瘍細胞などの細胞株にも拡大しました。
実験による当社のAd5/F35アデノウイルス品質の検証
VectorBuilderでは、独自の技術を数多く開発し、Ad5 / F35のパッケージングプロトコールを最適化してきました。当社で作製したAd5 / F35アデノウイルスは、従来のAd5アデノウイルスに比較して、低CAR発現細胞でも、はるかに高い形質導入効率を示すことが検証されています(図 2) 。
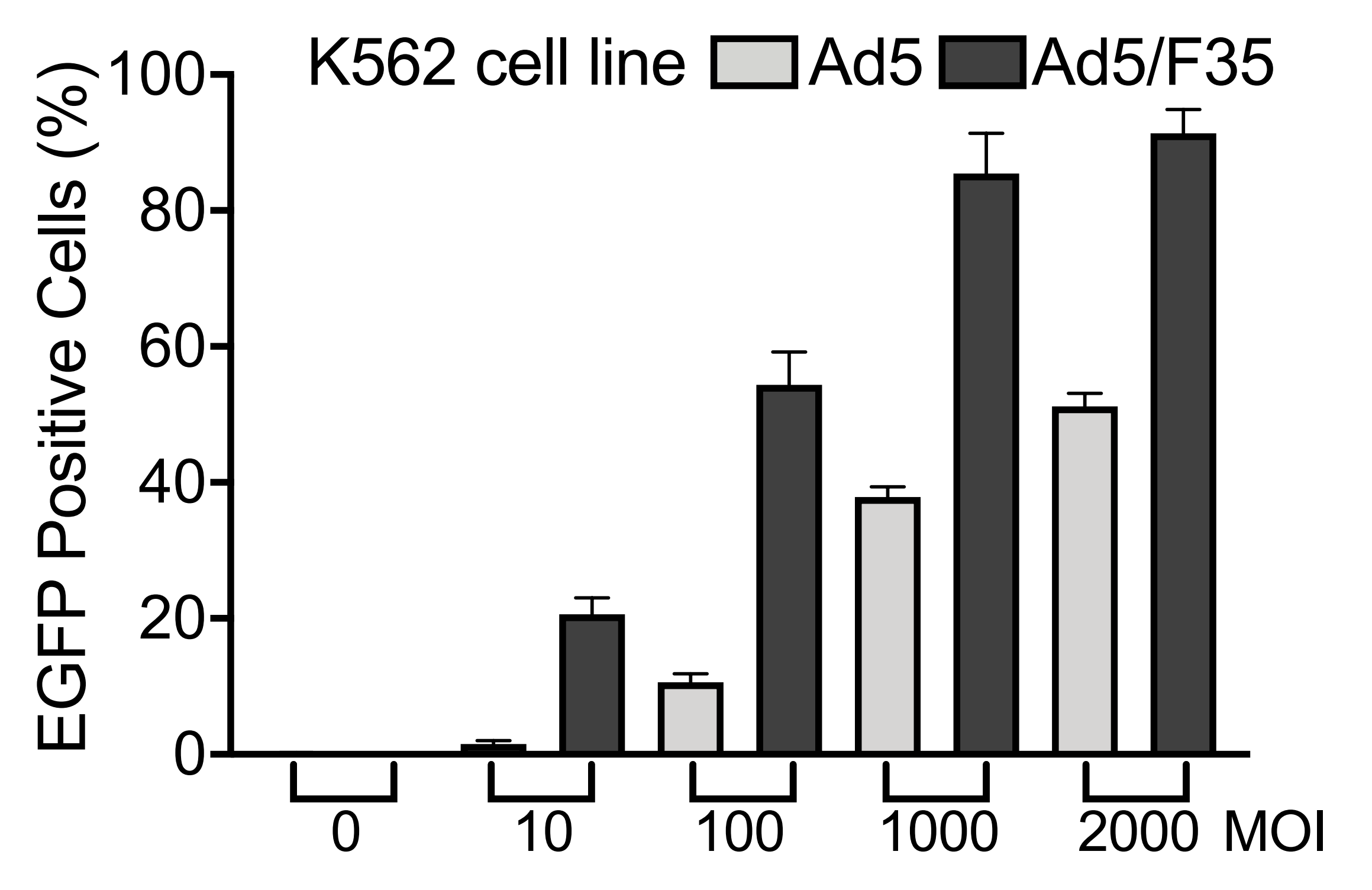
図 2. Ad5アデノウイルス、またはAd5/F35アデノウイルスをK562細胞に対する形質導入効率を検証した。多重感染度(MOI)を10-2000の間隔で調整し、K562細胞に対する形質導入効率を検証した。EGFP陽性細胞は形質導入の48時間後にフローサイトメトリーでカウントし、発現細胞率をプロットしている。K562細胞では、CAR発現が低レベルであることが知られている。
ガットレスアデノウイルス作製と品質検査
下の図1に示すように、ガットレスアデノウイルスの作成では、まずガットレスアデノウイルスプラスミドDNAベクターの5'-3'ITR間に、プロモーター下流にユーザー選択の目的遺伝子(GOI)を含む発現カセットをクローニングします。さらに、当社のベクターは、ビリオンが効率的にパッケージングされるように、2つの逆方向末端反復配列(ITR)間が28kb以上となるように、適切な長さのスタッファー配列をクローニングします。次に5'-3'ITR間にあるベクター領域を制限処理によって分離します。分離したフラグメントをパッケージング用細胞にトランスフェクトし、さらにヘルパーウイルスが感染することで、組み換えアデノウイルス粒子が産生されます。当社のガットレスアデノウイルスベクターシステムは、Creリコンビナーゼを安定して発現するパッケージング用細胞とともに2つのLoxP部位に隣接するパッケージングシグナルを持つヘルパーウイルスを利用して、ヘルパーウイルスパッケージングシグナルのCre媒介性切除を促進します。これにより、ヘルパーウイルスゲノムがガットレスアデノウイルスゲノムとともに産生するウイルス粒子にパッケージされることを防ぎます。パッケージング細胞で産生されたアデノウイルス粒子は細胞培養培地に放出され、収集します。
超純粋ガットレスアデノウイルス(in vivoグレード)の場合、ウイルス粒子はさらに精製され、塩化セシウム(CsCl)勾配超遠心分離によって濃縮されます。培養細胞グレード(in vitroグレード)のウイルスは、免疫細胞化学的手法でアデノウイルス特異的ヘキソンタンパク質を検出し測定することで、ウイルスのタイターを求めます。超純粋ガットレスアデノウイルスの場合は、ウイルス粒子の光学密度(OD260を使用)を測定してタイターを求めます。
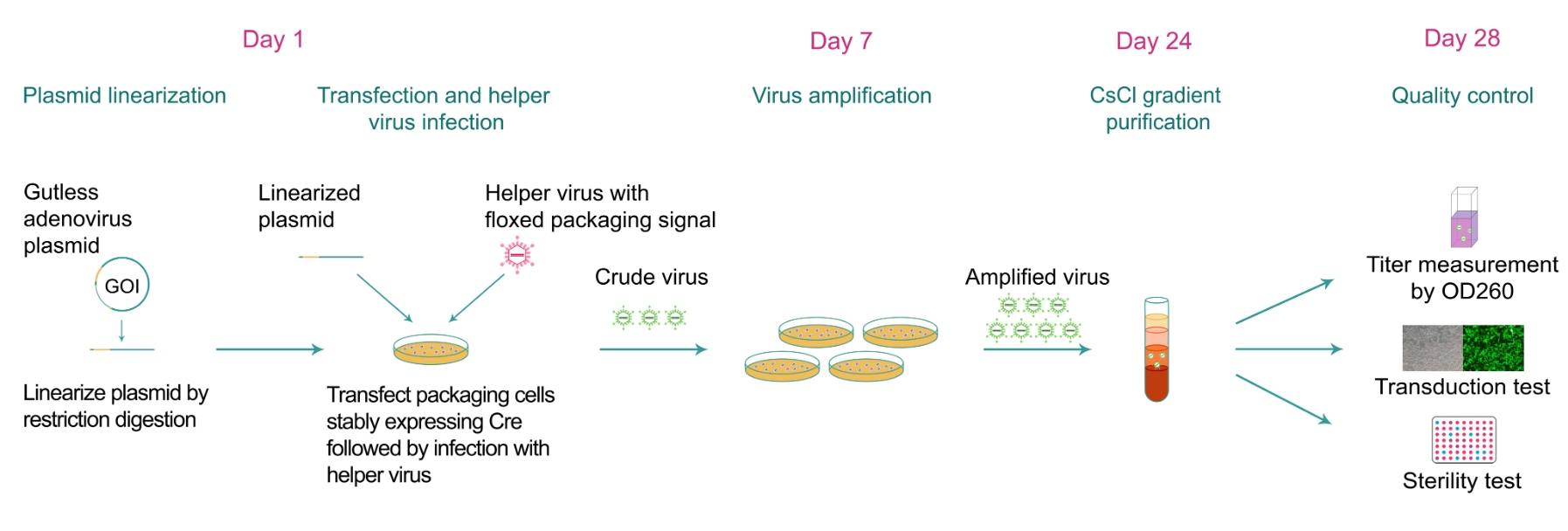
図1. ガットレスアデノウイルスパッケージングの一般的なワークフロー
VectorBuilderで作製した各アデノウイルスの品質管理には、タイター測定、細菌と真菌の無菌性テスト、およびマイコプラズマの検出によるデータが提供されます。アデノウイルスプラスミドDNAベクターが蛍光タンパク質マーカーをクローニングしている場合、作成したウイルスを培養細胞に感染させ、対応する蛍光マーカーの形質導入データを含みます。さらに、超純粋アデノウイルスは、エンドトキシンアッセイを定期的に実施して各ウイルスのエンドトキシンレベルをチェックしています。
Ad5やAd/F35アデノウイルスに対するガットレスアデノウイルスの優位性
ガットレスアデノウイルスベクター(別名ヘルパー依存型アデノウイルスベクター)は、従来のAd5またはキメラAd5/F35アデノウイルスベクターを代替する機能を持つ最新世代のアデノウイルスベクターです。ウイルスの複製とパッケージングに不可欠なシス作用エレメントは保持していますが、他のほぼ全てのウイルスゲノム配列を欠損しています。そのため、ガットレスアデノウイルスベクターは、in vivoで使用した場合、免疫原性が最小で、長期間の導入遺伝子発現が可能です。 したがって、Ad5またはAd5/F35に対して、安全性が大幅に改善されており、遺伝子治療方法として非常に有効な候補です。さらに、ウイルスゲノム配列を欠損しているため、最大33 kbの組み換え遺伝子の搭載力があり、大きな遺伝子や、複数遺伝子の同時形質導入に非常に適しています。以下の表は、各アデノウイルスベクターの特長を比較しています:
| ヒトAd5アデノウイルス | Ad5/F35アデノウイルス | Ad5ガットレスアデノウイルス | |
|---|---|---|---|
| 構造 | 5'と3'ITR間のゲノム領域にE1A、E1B、およびE3遺伝子欠失を持つヒトAd5アデノウイルスに由来 | EAd35に由来するノブとシャフトおよびAd5に由来するファイバーテールで構成されるキメラファイバータンパク質を発現する。さらに、5'と3'ITR間のゲノム領域は、E1A、E1B、およびE3遺伝子を欠失 | ヒトAd5由来。ウイルスの複製とパッケージングに不可欠なシスで作用するエレメントは保持しているが、他の全てのウイルスゲノムを欠失 |
| 搭載できるウイルスゲノムの長さ | 7.5 kb | 8.2 kb | 33 kb |
| 指向性 | 分裂細胞および非分裂細。CAR発現欠損細胞または低CAR発現細胞では形質導入効率が低い | 分裂細胞および非分裂細。 CAR発現細胞またはCAR非発現細胞でも高い形質導入効率 | 分裂細胞および非分裂細。 CAR発現欠損細胞または低CAR発現細胞では形質導入効率が低い |
| in vivoでの免疫原性 | 高い | 高い | 低い |
| ヘルパーウイルスは必要か? | 不必要 | 不必要 | 必要 |
実験によるウイルス品質の検証
当社では、独自の技術を数多く開発しガットレスアデノウイルスのパッケージングプロトコールを最適化しています。当社で作製したガットレスアデノウイルスは、哺乳類細胞株で高い形質導入効率を示すことを確認しています。


図 2. HeLa細胞に、mCherryを発現するガットレスアデノウイルスを、MOI 5000で感染させた。 倍率: 100x. 左: 細胞の明視野像、 右: mCherry(赤)を発現する細胞の蛍光像
ご注文方法
ユーザー提供のプラスミドDNAベクターからのウイルスパッケージング
ユーザー提供のアデノウイルスプラスミドを使用するウイルスパッケージングをご依頼の場合は マテリアルサブミッションガイド に従ってマテリアルを準備し、弊社に発送してください。ーザーからご提供されるマテリアルはVectorBuilderでお受け取り後、品質検査(QCチェック)に合格することを必須条件としています。QCチェックは、マテリアルごとに16,000円~、の追加料金が発生する場合があります。さらにQCチェックに合格するまで、ご依頼の受託サービスが開始することができません。そのため、正しくマテリアルを準備、発送し、プロジェクトが遅延しないよう心がけてください。
リソース
技術的情報
ユーザーインストラクション 化学物質等安全データシート (MSDS) 品質検査証明書 (Certificate of Analysis, COA)Q&A
| レンチウイルス | MMLV | アデノウイルス | AAV | |
|---|---|---|---|---|
| 組織指向性 | 広範 | 広範 | 数細胞種には不適 | ウイルスセロタイプに依る |
| 非分裂細胞への感染 | 感染する | 感染しない | 感染する | 感染する |
| 安定発現または一過性発現 | ゲノムへの挿入による安定発現 | ゲノムへの挿入による安定発現 | 一過的、エピソーマル | 一過的、エピソーマル |
| 得られる最高タイター | 高い | 中程度 | 高い | 非常に高い |
| プロモーターのカスタマイズ | 可 | 不可 | 可 | 可 |
| 主な使用系 | 培養細胞 &in vivo | 培養細胞 &in vivo | In vivo | In vivo |
| In vivoでの抗原性 | 低い | 低い | 高い | 非常に低い |
アデノウイルスは、機能的タイターを測定します。連続希釈したアデノウイルスをHEK293細胞に形質導入した後、免疫細胞化学に基づくアプローチを使用して、アデノウイルス特異的ヘキソンタンパク質の検出により正常に形質導入された細胞の数をカウントします。各免疫染色細胞を1つの感染ユニットと見なします。細胞は非常に低い多重感染度(MOI)で感染し、ほとんどの形質導入された細胞がそれぞれ単一のウイルス粒子に感染するようにします。このアッセイは、従来のプラークアッセイとの良好な相関関係を示します。超純粋アデノウイルスの場合、超純粋アデノウイルスの場合は、ウイルス粒子の光学密度をOD260で直接測定して、タイターを求めます。なぜなら光学密度と機能的タイターの間に密接な相関関係があるためです。アデノウイルスは非常に優れた安定性を持っています。当社のR&Dでは、当社で作成したアデノウイルス粒子は、室温下で何日も機能性を保持したまま安定に生きていることを認めています。
VectorBuilderで受託構築したアデノウイルスプラスミドベクターからアデノウイルスパッケージングを引き続きご注文いただき、かつパッケージングされる5’ITRから3’ITRまでの長さが38.7kb 以下の場合、最小タイター以上での保証を保障しています。以下の場合、タイター保証は適用外となっています:
- パッケージング上限サイズを超えた場合(5’ITRから3’ITRの長さが38.7kb以上):上限サイズを超えるとウイルスは不安定となり、パッケージされたDNAフラグメントにリアレンジメントやDNA欠損などが生じることが広く知られています。ウイルス粒子へのパッケージングは可能ですが、搭載した遺伝子の機能欠損やタイターの極端な低下が生じることも知られています。
- ウイルスベクターに搭載されたORFがパッケージング過程に負の影響を及ぼす場合:細胞毒性を持つ遺伝子(例、プロアポトーシス遺伝子群)、パッケージング細胞やウイルスの生合成に影響を与える遺伝子(例、凝集性を持つ膜タンパク遺伝子)、遺伝子シークエンスが塩基配列のリアレンジメントや二次構造をとるような遺伝子(例、反復配列や高GC-richシークエンス)。
- ユーザーご提供のプラスミドDNAを使ってウイルスパッケージングを行わせていただく場合:弊社のウイルスパッケージングプロトコールは、弊社で構築したベクターバックボーンに対して最適化されています。また、弊社にシークエンスを公開できないプラスミドDNAや、非定型のアデノウイルス機能シークエンス(例、ITRなど)からのパッケージングには不確定要素が多く、タイター保証のご提供には限界があります。
その他、お見積りの際に弊社よりご連絡させていただいたタイター低下リスクを、ユーザーにご同意いただき、パッケージングを受注させていただく場合もあります。できる限り高タイターでの納品を行いますが、生物学的バリアーによって困難な場合もあることをご了承ください。パッケージングの進捗に関しては弊社にメールにてお問い合わせください。
作業日数には、ご注文いただいた受託サービスが弊社で受注され、製造が完了し、弊社製造拠点から出荷されるまでの期間を指しています。ユーザーご提供のプラスミドDNAを使っての受託ウイルスパッケージングの場合、プラスミドDNAの受け入れやQCチェックにかかる日数は作業日数に含まれていません。





