レンチウイルス作製サービス
レンチウイルスベクターは、哺乳類細胞に遺伝子導入を行う際に、最もよく使われるウイルスベクターの一つです。一過的でエピソーマルな外来遺伝子の発現に使われるプラスミドDNAとは異なり、レンチウイルスベクターはホスト細胞のゲノムに挿入されることで永続的な外来遺伝子の発現を実現します。さらにレンチウイルスはin vivoでの遺伝子導入ツールとしても大変効果的です。
VectorBuilderは高い品質のレンチウイルスベクター受託作製サービスをご提供しています。当社が独自に開発した一連の技術と試薬を用いて、タイター、純度、生存率、均一性に優れたレンチウイルスを製造するプロトコールを改良しました。当社の第3世代レンチウイルスプラスミドベクター構築に引き続いてウイルスパッケージングまでの一連の受託サービスをご注文いただき、高品質のウイルスベクターをご体験ください。ユーザ―満足度の高さは、世界中のユーザーからのリピート注文率に現れています。また当社では近年、 GMP-グレードのレンチウイルス製造 も開始し、医療利用への受託サービスも行っています。
ご提供しているレンチウイルスの種類
- VSV-G シュードタイプ第3世代レンチウイルス(デフォルトベクターフォーマット)
- VSV-G シュードタイプ第2世代レンチウイルス
- VSV-G インテグレーション欠損型 第4世代レンチウイルス
- カスタムエンベロープタンパク質のシュードタイプレンチウイルス(例、コロナウイルススパイク(S)タンパク質)
- エンベロープタンパク質欠損型禿げレンチウイルス(レンチウイルスによる形質導入のネガティブコントロール)
サービスの詳細
価格と作成作業日数 プライスマッチ
| スケール | 推奨使用系 | 一般的なタイター | 最小タイター | 容量 | 価格(税別、送料別) | 作業日数 |
|---|---|---|---|---|---|---|
| お試し用ミニ | 培養細胞 | >2x108 TU/ml | >108 TU/ml | 100 ul (4x25 ul) | 31,000円 | 6-12 日 |
| パイロット | >4x108 TU/ml | 250 ul (10x25 ul) | 70,000円 | |||
| 中容量 | >3x108 TU/ml | 1 ml (10x100 ul) | 101,000円 | |||
| 大容量 | >2x109 TU/ml | >109 TU/ml | 1 ml (10x100 ul) | 170,500円 | ||
| 超純粋中容量 | 培養細胞 & in vivo | 500 ul (10x50 ul) | 217,000円 | |||
| 超純粋大容量 | 1 ml (10x100 ul) | 263,500円 |
TU=形質導入ユニット(感染ユニット)
価格は予告なく変更される場合があります。
納品形態
| 培養細胞用レンチウイルス | 超純粋レンチウイルス |
|---|---|
| カスタムレンチウイルス | カスタムレンチウイルス |
|
無料:標準コントロールウイルス
|
追加購入(オプション): 超純粋標準コントロールウイルス
|
|
無料: ポリブレン(5mg/ml, 200ul) |
無料:ポリブレン(5mg/ml, 200ul) |
|
メール添付:カルタヘナ法26条1項情報公開書類、品質検査証明書(COA) |
メール添付:カルタヘナ法26条1項情報公開書類、品質検査証明書(COA) |
既成標準コントロールウイルス
カスタムウイルスをご購入いただく場合、 既製標準コントロールウイルスを無料(パイロット、中容量、大容量用)または割引特価(超純粋中容量、超純粋大容量用)でご提供しています。既製標準コントロールウイルスは、感染効率の最適化などの目的に使用していただけるコントロールウイルスです。例えば、カスタムウイルスが目的遺伝子の強制発現系であれば、コントロールはEGFPを強制発現するウイルスです。カスタムウイルスがshRNAの発現系では、コントロールはscramble shRNAを発現するウイルスです。そのため、ご注文いただくカスタムレンチウイルスの厳密な実験用コントロールウイルスではありません。カスタムコントロールがお入用な場合は、別途ベクターデザインとお見積りが必要です。既製標準コントロールウイルス仕様:
| ベクターシステム | コントロールウイルスベクター名称 | コントロールベクターID |
|---|---|---|
| レンチウイルス発現ベクター | pLV[Exp]-EGFP/Puro-EF1A>mCherry | VB010000-9298rtf |
| レンチウイルスCRISPRベクター | pLV[Exp]-EGFP/Puro-EF1A>mCherry | VB010000-9298rtf |
| レンチウイルスU6型shRNAノックダウン | pLV[shRNA]-EGFP/Puro-U6>Scramble_shRNA | VB010000-0009mxc |
| レンチウイルスmiR30型shRNAノックダウン | pLV[miR30]-EGFP/Puro-EF1A>mCherry:Scramble_miR30-shRNA | VB010000-9387zjj |
| レンチウイルスIPTG誘導型shRNAノックダウンシステム | pLV[shRNA]-LacI/Puro-U6/2xLacO>Scramble_shRNA | VB010000-9348prq |
保存方法
当社のレンチウイルスはHBSSバッファーに保存され、ドライアイス詰めで出荷されます。お受け取り後、長期保存は-80°Cで最低6か月安定です。-20°C では1週間安定です。正しい保存温度を守られた場合、使用期限は約1年です。大きなタイターの低下を招く凍結融解は避けてください。
技術的情報
レンチウイルス作成と品質検査
第3世代レンチウイルスパッケージングは、目的遺伝子(GOI)をクローニングしたトランスファーベクターを当社で開発したVSV-G エンベロープタンパク質ベクターとGag/PolそしてRevをコードするパッケージングプラスミドとともにウイルス産生細胞のHEK293T細胞に共形質転換を行います。48時間のインキュベーション後、上清を集め遠心をかけることで細胞の残渣を除去し、フィルターにかけ、レンチウイルス粒子をPEG濃縮を行います。超純粋グレード(in vivo用)のレンチウイルスは、ショ糖濃度勾配超遠心による精製と限外ろ過による濃縮を行っています。レンチウイルスのタイターは p24 ELISA法によって測定しています。
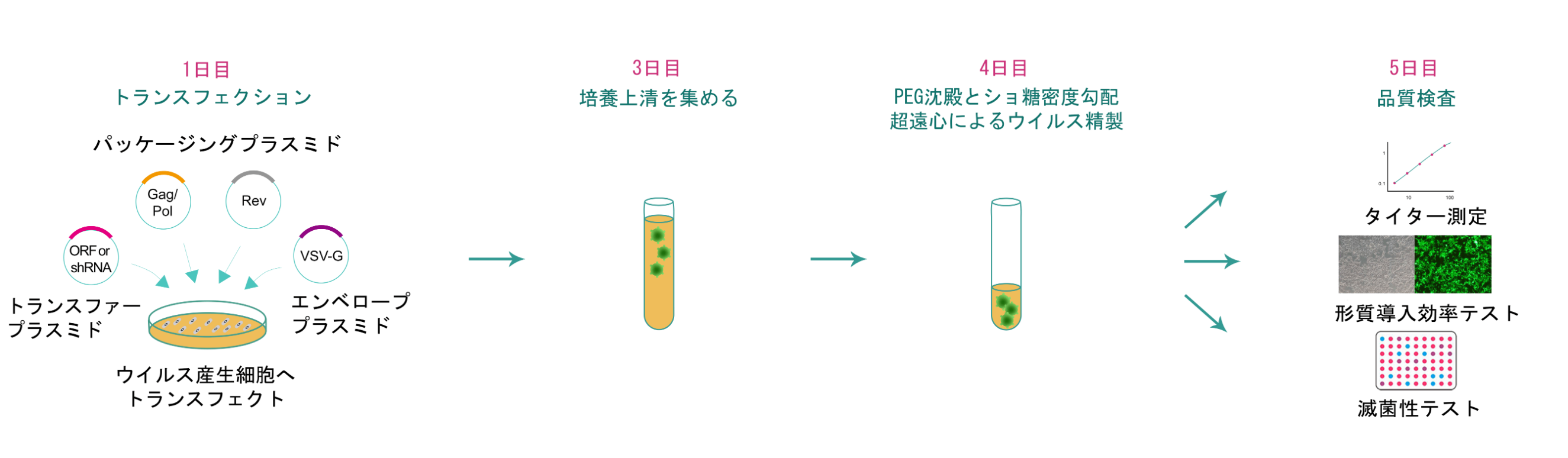
VectorBuilderによって生成された各組換えレンチウイルスの品質管理には、タイター測定、細菌および真菌の無菌試験、およびマイコプラズマ検出が含まれます。またウイルスのトランスファーベクターが蛍光タンパク質をコードしている場合、対応する蛍光を検出するためにHEK293T細胞に形質導入テストを実行します。トランスファーベクターが薬物選択マーカーをコードしている場合、形質導入試験を実施した後、対応する薬物選択を行います。さらに、超純粋レンチウイルスについては、エンドトキシンアッセイを実施してエンドトキシンレベル値もご提供しています。COAへエンドトキシンアッセイ結果の記載するためには追加費用が発生します。ご希望の追加QCにも対応可能です。
ご注文方法
ユーザー提供のプラスミドDNAベクターからのウイルスパッケージング
ユーザー提供のレンチウイルスプラスミドをパッケージに使用する場合は マテリアルサブミッションガイドライン に従ってマテリアルを準備し、弊社に発送してください。ユーザーからご提供されるマテリアルはVectorBuilderで受け取り後、品質検査(QCチェック)に合格することを必須条件としています。QCチェックは、マテリアルごとに16,000円からの追加料金が発生する場合があります。さらにQCチェックに合格するまで、ご依頼の受託サービスが開始することができません。そのため、正しくマテリアルを準備、発送し、プロジェクトが遅延しないよう心がけてください。
リソース
技術的ドキュメント
ユーザーインストラクション 化学物質等安全データシート (MSDS) 品質検査証明書(COA)Q&A
| レンチウイルス | MMLV | アデノウイルス | AAV | |
|---|---|---|---|---|
| 指向性 | 広範 | 広範 | 感染しない細胞がある | 血清型に依る |
| 非分裂動物細胞への感染 | 感染する | 感染しない | 感染する | 感染する |
| 安定発現または一過的発現 | ゲノム挿入による安定発現 | ゲノム挿入による安定発現 | 一過的発現、エピソーマル | 一過的発現、エピソーマル |
| 最高タイターの相対的評価 | 高い | 中程度 | 高い | 大変高い |
| プロモーター選択の自由度 | 自由度あり | 自由度なし | 自由度あり | 自由度あり |
| 至適使用系 | 培養細胞とin vivo | 培養細胞と in vivo | In vivo | In vivo |
| 生体での免疫原性 | 低い | 低い | 高い | 大変低い |
レンチウイルスタイターの測定にはp24ELISAを使用します。この方法ではサンドイッチイムノアッセイを使用してレンチウイルス上清中のHIV-1p24コアタンパク質のレベルを測定します。抗HIV-1 p24キャプチャー抗体でコーティングされたマイクロタイタープレートにレンチウイルスサンプルを加えてレンチウイルスサンプル中のp24に結合させます。続いてビオチン化抗p24二次抗体が添加され、プレート上の一次抗体によってキャプチャーされたp24に結合します。次にストレプトアビジンとビオチンの相互作用によってトレプトアビジン-HRPコンジュゲートをビオチン化抗p24抗体に結合させます。最後にHRP基質溶液がサンプルに追加され、酵素反応によって発色します。発色強度は各レンチウイルスサンプルに存在するp24の量に比例します。分光光度計を使用して強度を測定し、組換えHIV-1p24標準曲線と比較することによって正確に定量化されます。p24値は、対応するレンチウイルスサンプルのウイルスタイターと相関関係にあります。
当社のタイター保証は、ウイルスにパッケージされている領域(Δ5'LTRからΔU3/ 3'LTRまで)がレンチウイルスの搭載制限(9.2 kb)を下回っているベクターに適用されます。搭載制限を超えるサイズの場合でも、ベクターをウイルスにパッケージすることは可能かもしれませんが、タイターが低下する可能性があります。ベクターが以下に該当する場合は当社の到達目標タイター保証は適用できません:
- 毒性遺伝子(例:アポトーシス促進遺伝子)、パッケージング細胞またはウイルスの完全性を損なう遺伝子(例:細胞凝集を引き起こす膜タンパク質)などのパッケージングプロセスに悪影響を与える可能性のある配列を含むベクター、および欠失や二次構造を取りやすい配列(例:反復配列または非常にGC含量が高い配列);
- パッケージング効率に不確実性をもたらす可能性のある、非公開の配列または非定型レンチウイルス機能要素(LTRなど)を含むユーザー提供のプラスミドの場合。
製造作業日数はプロジェクト開始から完了までの日数です。お客様から提供されたマテリアル(プラスミドDNAやウイルスベクターなど)が弊社製造拠点に到着するまでの待ち日数、マテリアルの品質検査にかかる日数、そして完成した納品物をお客様に発送するための輸送日数は含まれていません。





