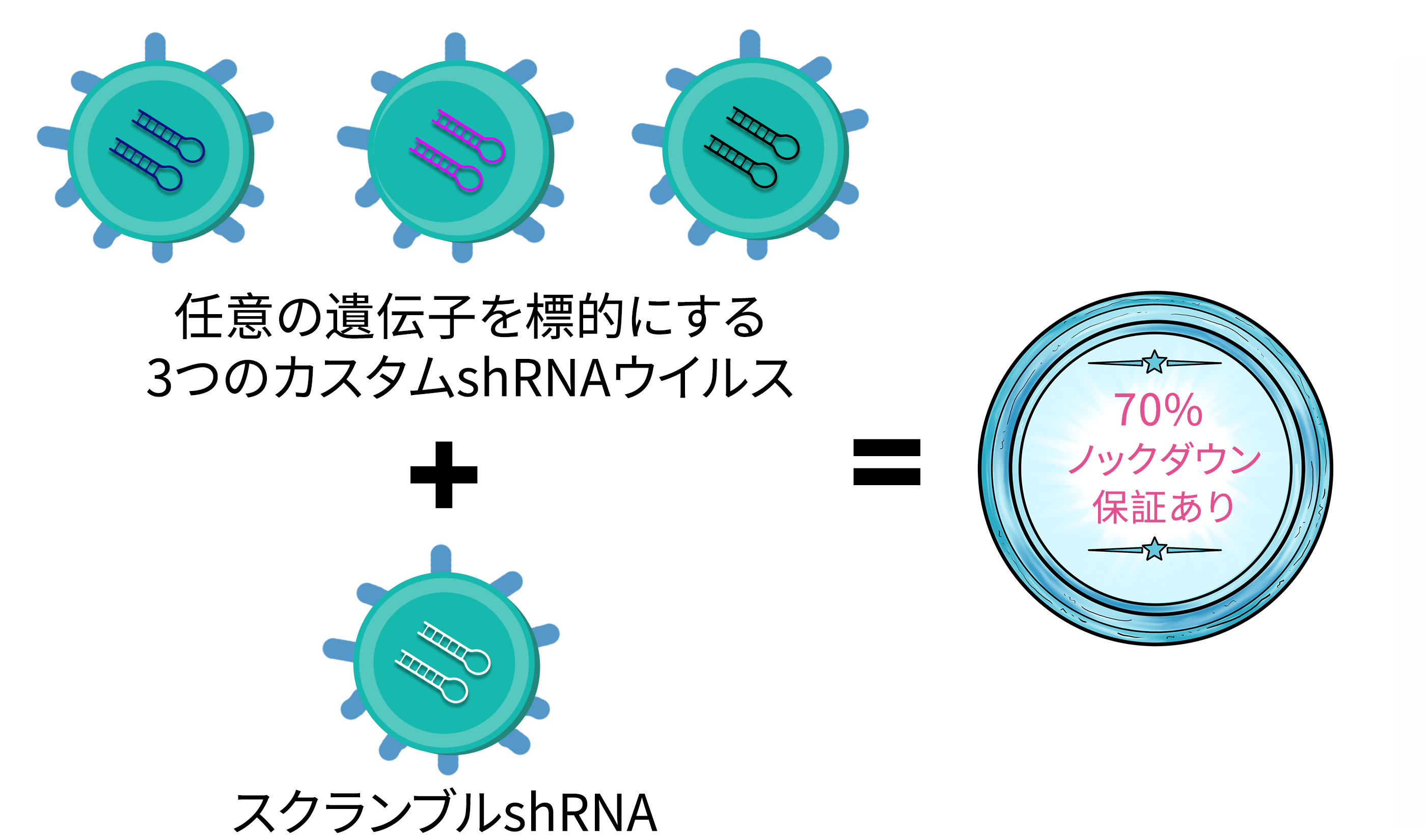
shRNA (3+1) ウイルスパッケージング
shRNAウイルス注文情報 プライスマッチ
| ウイルス | スケールと納品物 | 使用系 | 価格 (消費税・送料別)* | 作業日数** |
|---|---|---|---|---|
| レンチウイルス | お試し用ミニ | 培養細胞 | 139,500円 | 10-19 日 |
| パイロット | 232,500円 | |||
| 中容量 | 310,000円 | |||
| 大容量 | 465,000円 | |||
| 超純粋中容量 | 培養細胞 & in vivo | 620,000円 | ||
| 超純粋大容量 | 744,000円 | |||
| AAV | パイロット | 培養細胞 | 232,500円 | 10-19 日 |
| 中容量 | 310,000円 | |||
| 大容量 | 465,000円 | |||
| 超純粋パイロット | 培養細胞 & in vivo | 651,000円 | 11-21日 | |
| 超純粋中容量 | 883,500円 | |||
| 超純粋大容量 | 1,364,000円 | |||
| アデノウイルス | パイロット | 培養細胞 | 372,000円 | 34-47 日 |
| 中容量 | 558,000円 | |||
| 大容量 | 728,500円 | |||
| 超純粋中容量 |
培養細胞 & in vivo |
961,000円 | 34-47 日 | |
| 超純粋大容量 | 1,162,500円 |
* 価格にはベクター構築価格とウイルスパッケージング価格の両方を含みます。基本納品はウイルスのみとなります。ベクター構築を行ったプラスミドDNAまたは大腸菌グリセロールストックの納品が必要な場合は、別途ご連絡ください。
** 作業日数とは、ベクター構築とウイルスパッケージングの所要合計日数です。
*** 価格は予告なく変更される場合があります。

ノックダウン保障:shRNA (3+1)ウイルスセットを、当社のshRNAリストからトップ3を選択されたにも関わらず、目的遺伝子のノックダウンが >=70%を達成できなかった場合、4種類目のshRNA Virusを無料でご提供します。(注:4種類目のウイルスをドライアイス発送する際、送料手数料のご負担が発生いたします。ご了承ください)。
目的遺伝子に対するshRNA をベクターピッカーを使って選択します:
ベクターピッカーを使って、目的遺伝子に対する特定の shRNAs シークエンスが選び出せない場合は、 デザインサポートを依頼する より、ご希望のシークエンスをご連絡ください。ベクターデザインチームがカスタムでベクターデザインを行います。
基本納品形態:ready-to-use ウイルス粒子
注:shRNAカスタムプラスミドDNAベクターは納品物に含まれていません。カスタムプラスミドDNAベクターの納品も必要な場合は、ご注文時にあらかじめ弊社までご連絡ください。ウイルス納品に同梱して無料で分譲いたします。プラスミドDNAの納品形態はいずれかを選択してください:1)サンガーシークエンスに使った残りのプラスミドDNA(2-3ug, in 10ul TE),または、2)VB UltraStable 大腸菌に形質転換したグリセロールストック。カルタヘナ法26条1項情報公開書類を添付。
コントロールのスクランブルプラスミドDNAベクターは有料となります。お問合せください。
shRNAベクター情報
ご提供しているshRNAベクターシステム
shRNA (3+1)ウイルスパッケージングサービスをご提供しているウイルス種は、レンチウイルス、AAV、アデノウイルスです。AAV には、次のセロタイプをご用意しています: 1, 2, 3, 4, 5, 6, 6.2, 7, 8, 9, rh10, DJ, DJ/8, PHP.eB, PHP.S, AAV2-retro, AAV2-QuadYF そして AAV2.7m8.
これらの標準ベクターバックボーンは、大腸菌内でプラスミドDNAを高コピーで増幅し、さらにウイルス産生細胞で、組み換えウイルスゲノムをもつウイルスが高タイターで産生できるように弊社R&Dで最適化しています。カスタムshRNAシークエンスは、human U6 プロモーターでドライブします。レポーター遺伝子のプロモーターは各ウイルスベクターバックボーンによってことなります。下のベクターマップをご確認ください。
蛍光レポーター遺伝子:EGFP. mCherryそしてTagBFP2からご選択いただけます。(コントロールウイルスの蛍光レポーター遺伝子はカスタムで選択された蛍光レポーター遺伝子と同一になります。)
スクランブルshRNAシークエンス:CCTAAGGTTAAGTCGCCCTCG
リソース
shRNAに関するQ&A
生物医学研究で使用される一般的なウイルスベクターは、レンチウイルス、アデノ随伴ウイルス(AAV)、およびアデノウイルスが含まれ、それぞれのウイルス種に長所と短所があります。以下の表は、実験に適したウイルスベクターを選択する際に考慮すべき重要な要素を示しています。
| レンチウイルス | AAV | アデノウイルス | |
|---|---|---|---|
| 指向性 | 広範 | セロタイプによる、広範 | 特定の細胞種 |
| 非分裂細胞への感染性は? | 感染する | 感染する | 感染する |
| ゲノムへの安定インテグレーションによる遺伝子導入または一過的遺伝子導入導入 | ステイブル | 一過的、エピソーマル | 一過的、エピソーマル |
| 細胞タイター | 高タイター | 高タイター | 非常に高タイター |
|
プロモーターのカスタム選択性 但し(3+1)shRNAの場合はU6 promoterで固定 |
可能 | 可能 | 可能 |
| 使用系 | 培養細胞と in vivo | In vivo | In vivo |
| in vivoに使用した場合の免疫反応 | 低い | 非常に低い | 高い |
物理的または機能的(生物学的)タイターの測定を行います。ウイルス種によって採用しているタイター測定法が異なるため、下の説明をご参照ください。
また、shRNA(3+1)のウイルスベクターは蛍光レポーター遺伝子がクローニングされています。ウイルス回収後、標準的な細胞株(例 293T または 293A)に感染実験をおこない、蛍光タンパク質の発現確認によって、ウイルスの品質を評価します。蛍光タンパク質の発現確認結果と機能的/生物学的タイター測定値に乖離があった場合、VectorBuilderでは、再測定、追加検証、あるいはウイルスの再生産を行うことで、高品質のウイルスをユーザーにお届けいたします。
レンチウイルス
レンチウイルスのタイター測定は、p24 Elisa を使用しています。この方法はサンドイッチイムノアッセイに基づいたテクニックで、レンチウイルスの上清中のHIV-1 p24 コアタンパク質を測定することで機能的タイターを求めます。
方法:マイクロタイタープレートの各ウエルは、抗HIV-1 p24キャプチャー抗体でコートされています。そのウエルに、タイターを測定するレンチウイルスサンプルを加えます。レンチウイルスはエピトープであるp24を介して、ウエルに補綴されます。次に、二次抗体のビオチンコンジュゲート-抗p24抗体、さらにHPRコンジュゲートストレプトアビジンを加えて、シグナルを増強させます。最後にHRPの基質試薬を加え発色させ、発色強度を分光光度計を使って測定します。予め決定しておいたp24スタンダードカーブから相対的なレンチウイルスタイターを割り出します。
アデノ随伴ウイルス (AAV)
AAVでは。ウイルス粒子からウイルスゲノムDNAを抽出し、qPCR法によって物理的タイターを求めます。
方法:ウイルス粒子からウイルスゲノムDNAを抽出します。qPCRに使うプライマーはAAV2のITRにアニールするようにデザインされています。qPCRでは、ウイルスゲノムのコピー数を正確に定量化することにより、AAVの物理的タイターが正確に測定されます。AAV粒子は大変安定で、VectorBuilderが作成したAAVは全て生存し、室温下でも数日は機能を維持しています。弊社のAAVは、ウイルスゲノムサイズが搭載上限サイズを超えず、かつ精製度の高いAAVの場合、物理的タイターと機能的タイターは非常に近い値となっっています。
アデノウイルス
アデノウイルスのタイターは、作製したアデノウイルスの段階希釈をHEK293細胞に感染させ、免疫細胞学的手法で、アデノウイルス特異的ヘキソンタンパク質を検出し、形質導入されている細胞数をカウントすることで機能的タイターを求めます。
方法:アデノウイルスの段階希釈を作成し 293A 細胞に感染させます。感染に成功した細胞は、抗ヘキソン抗体の免疫染色によって検出されます。この方法で免染された各細胞は1infectious unitとみなします。HEK293細胞は、非常に低い感染多重度 (multiplicity of infection:MOI) で感染させ、検出された細胞は単一のウイルス粒子に感染したことを保証します。このアッセイ法は、従来のプラークアッセイ法と相関関係があります。
超純粋アデノウイルスの場合は、ウイルス粒子のOD260オプティカルデンシティーを測定し、物理的タイターを求めます。超純粋アデノウイルスの場合、オプティカルデンシティーで求めた物理的タイターと機能的タイターに強い相関関係があるため、結果が早く得られる方法を選択しています。 アデノウイルスは大変安定で、VectorBuilderが作成したアデノウイルスは全てのウイルスが生存し、室温で放置しても数日間は機能を保持しています。
VectorBuilderのshRNAは RNAi consortium (TRC) のアルゴリズムをベースとして改良したshRNAデザインとスコアーを採用しています。各RefSeq に登録されている転写産物に対して、ターゲットサイトの候補となる21merシークエンスが全て同定されています。候補ターゲットサイトは、ノックダウン効率や特異性を低下させるような特長が検出されたり、クローニング不可性 (同一塩基≥4 連続、G または C塩基の≥7連続、GC 含量<25% またはGC含量>60%、そして 5’末端にAA )が検出された場合、候補から除外されます。ノックダウンスコアーは、内部にステムループ構造を持つ、3’末端に向てGC含量が高くなる、既知の miRNA シードシークエンス、他の遺伝子に対するオフターゲットマッチなどが検出されるとペナルティーをつけ、スコア化しています。また、1遺伝子に対して複数の転写産物が同定されている場合(alternative transcripts)、全ての転写産物に対して、最も高いスコアーを出すターゲットサイトを選び出しています。
全てのスコアーは ≥0以上の数字で、中間値(mean)が ~5、そして標準偏差が ~5となっています。95% のshRNAでスコアーは≤15となっています。例えば、あるshRNAのノックダウンスコアーが15であるとすると、最も効果の高いノックダウンパフォーマンスが予想され、クローニングも可能と判断されます。一方、ノックダウンスコアーが0のshRNAでは、最悪のノックダウンパフォーマンス、またはクローニング不可能なターゲットシークエンスと判断されます。
ただ、ノックダウンスコアーはあくまでも予測シークエンスです。実際のノックダウン効率はスコアーからかけ離れている場合もあるかもしれません。低いノックダウンスコアーが与えられたターゲットシークエンスでも、shRNAとして研究論文につかわれていて、比較的よくワークしている場合もあります。また、3'UTR領域のターゲットでも、コーディング領域のターゲットの場合と同様に効果があることも念頭に置いてください。
全てのshRNAが効果的にワークするわけではありません
VectorBuilderの経験と、ユーザーからのフィードバックを総合すると、一般的にある遺伝子に対して 3 ー4 種類のshRNAを試した場合、 2-3種類のshRNAで満足いくノックダウン効果が得られていることがわかっています。しかし選択した全てのshRNAがワークするわけではないことは必ず念頭に置いてください。一般的に、~50-70% のshRNAがノックダウンの表現型を表し、そのうちの ~20-30% は強いノックダウン効果を表します。仮に1-2種類のターゲットshRNAシークエンスを特定の1遺伝子に試した場合、チャンスとしては満足いくノックダウン効果が観察されないこともあり得ます。その場合、検証された別のshRNAを試すことが勧められます。複数の異なるshRNAをミックスした“カクテル” shRNAを試す場合もあり、ノックダウン効率の改善に役立つこともあります。
目的遺伝子のノックダウン効果を検証するアッセイ系が正しく実施できていない
最も一般的で感度の高いshRNAノックダウンの評価アッセイ系はRT-PCRです。複数のプライマーペアーを試し、最も特異性の高いプライマーペアーを使うことをお勧めします。一般的に、RT-qPCRのプライマーは、exon-exonのジャンクションシークエンスを挟むことで、サンプルにコンタミしたゲノム由来のDNAからの増幅を避けるようにデザインします。新しいプライマーペアーを試す際は、アガロースゲル電気泳動でバンドサイズを確認したり、サンガーシークエンスで増幅したPCR産物の確認を行うこともあります。RT-PCRには、必ずminus-RTコントロールを取って、ゲノムDNAのコンタミ率を概算できるようにしてください。 NCBI primer designing tool はデザインしたプライマーをコンピューター上(in silico)で検証できる良いツールです。
ウエスタンブロッティングもノックダウン効率検証のよいアッセイ系です。弱点は使用する抗体によっては非特異的な偽陽性バンドが出てしまい、結果を見誤るリスクがあることです。ウエスタンブロッティングに使う抗体は、目的遺伝子産物を特異的に認識することを予め確認してから使用してください。
shRNAが目的遺伝子の転写アイソフォームの一部にしかターゲッティングできていない
shRNAをデザインする際、目的遺伝子にisoformが存在する場合は、できる限り多くのisoformをターゲットできるようにデザインすることをお勧めします。 反対に、特定のisoformのノックダウンでは、可能な限り特異性の高いターゲットを選択してください。VectorBuilderは、特定の動物種に対して、最適化したshRNAデータベースを確立しています。shRNAベクターをご自分でデザインし、VectorBuilderに受託構築をご依頼いただく際は、VectorBuilderのデータベースをお試しになられることをお勧めします。このデータベースには、全てのshRNAのリスト、シークエンス、スコアーが一覧表示され、かつUCSC Genome Browserへのリンクからゲノムシークエンスのどの位置にターゲットシークエンスが位置するか確認することができます。



