CRISPRノックイン細胞株
VectorBuilderは、任意のゲノム標的部位に目的遺伝子(GOI)をノックインした細胞株を作製いたします。ノックインするためには、標的部位に特異的なgRNA/Cas9 RNP複合体を相同組み換え修復(HDR)用のテンプレート配列を持つドナーベクターと共に細胞へ導入するCRISPR遺伝子編集技術を用います。弊社独自の技術により、非常に効率的な遺伝子導入とHDRを実現し、それによって短い作業日数と高いホモ接合体ノックイン成功率を可能としています。
特長
- 優れた組み換え効率: 弊社独自のドナーデザインと遺伝子導入アプローチにより、ほとんどの細胞で30~50%のHDR率を達成。
- 大きなDNA配列のノックイン: ESCやiPSCを含む様々な細胞に、1kbまでのフラグメントを効率的に挿入可能。
- 短い作業日数: ベクター設計からモノクローナルのノックイン細胞株樹立まで最短16週間で実現。
サービス詳細
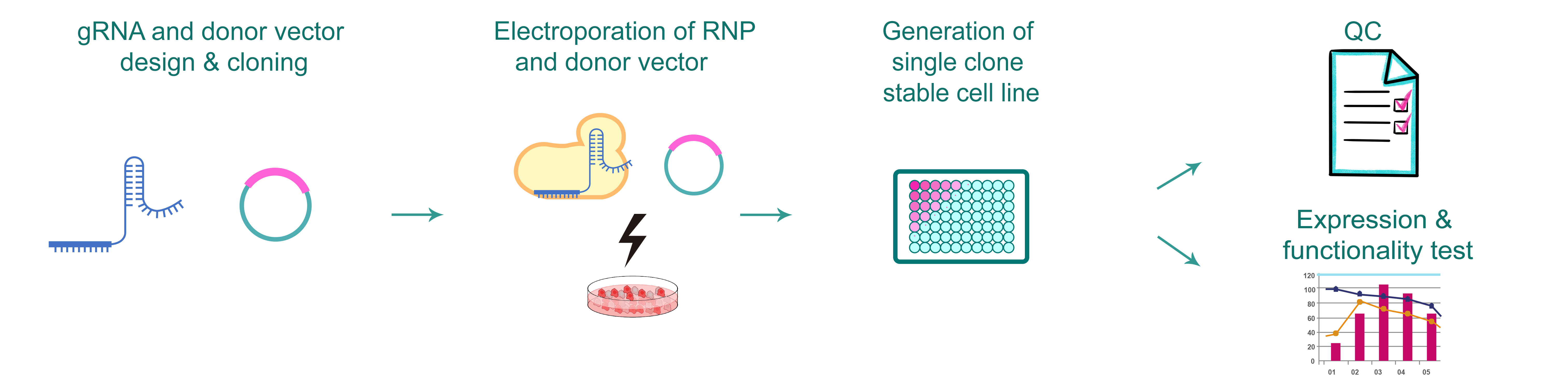
図1. CRISPR 遺伝子編集による遺伝子ノックイン細胞作製のワークフロー。
価格と作業日数 プライスマッチ
| サービス | 納品形態 | 価格 (税別、送料別)* | 作業日数 |
|---|---|---|---|
| ノックイン(3 kb以下) | ヘテロ接合体 1クローン (>106 細胞/バイアル, 2本) | 1,240,000円より | 14-20 週間 |
| ホモ接合体 1クローン (>106 細胞/バイアル, 2本) | お問い合わせください | ||
| ノックイン(3 kb以上) | ヘテロ接合体 1クローン (>106 細胞/バイアル, 2本) | 1,705,000円より | 16-24 週間 |
| ホモ接合体 1クローン (>106 細胞/バイアル, 2本) | お問い合わせください | ||
* 追加のクローンまたはバイアルには追加料金がかかります。
QCアッセイ
| アッセイ内容 | 検査方法 |
|---|---|
| ノックイン確認 (デフォルト) | ジェノタイピングPCR, サンガーシークエンス |
| 発現テスト (オプション) | RT-qPCR, WB, IF, FACS |
| オフターゲット検査 (オプション) | NGS, PCR, サンガーシークエンス |
| 染色体検査 (オプション) | 核型検査 |
| 無菌試験 (デフォルト) | マイコプラズマテスト(PCR), バイオバーデン試験 |
解析の追加
ご要望に応じて、増殖、アポトーシス、遊走、生存率、細胞毒性などのアッセイを含む、樹立細胞株の様々な表現型評価や機能検証を実施いたします。
ケーススタディ
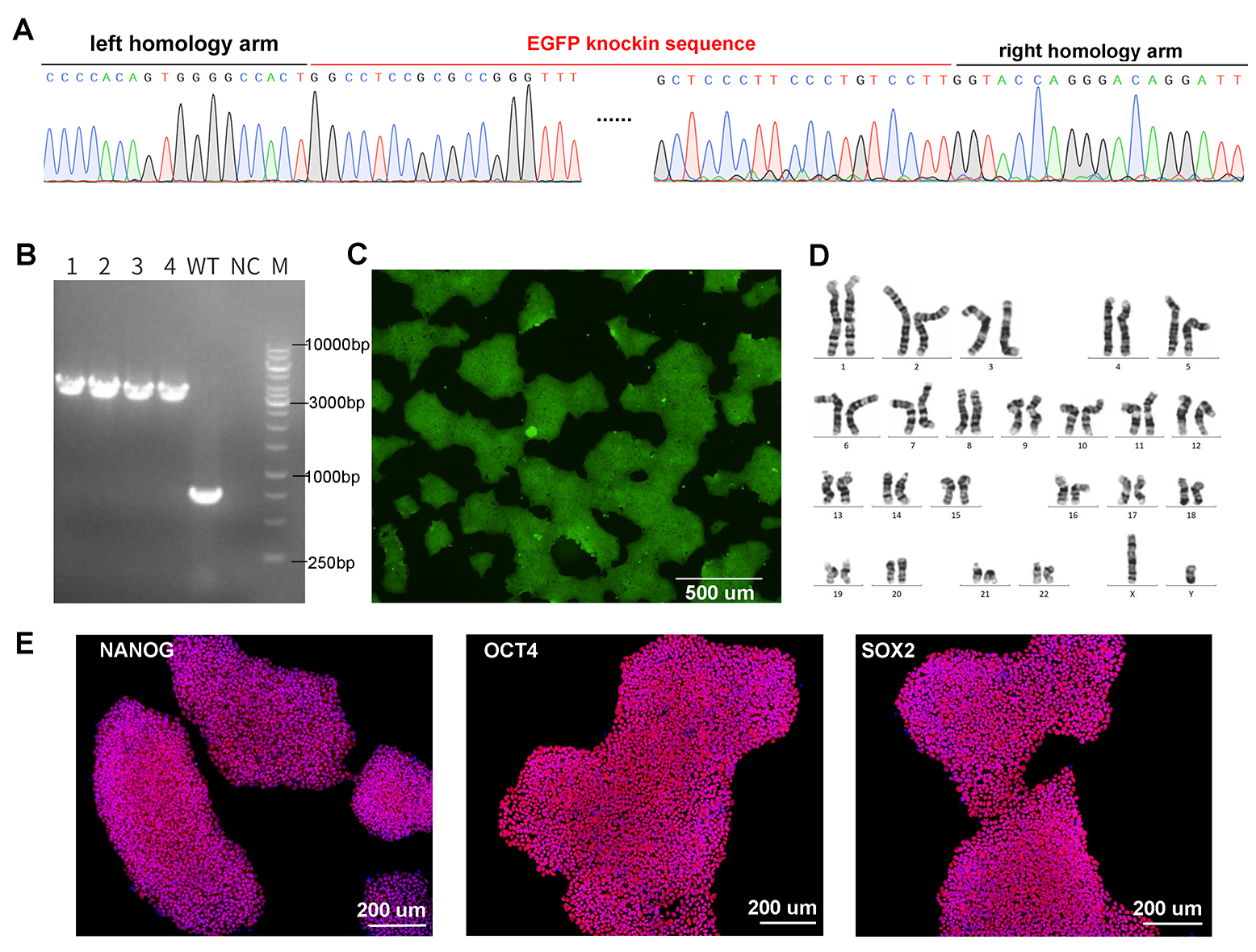
図2. iPS細胞におけるCRISPR遺伝子ノックイン。iPS細胞へのUBCプロモーター>EGFP(2432bp)のノックインを、Cas9/gRNA RNP複合体とドナーベクターの同時エレクトロポレーションによって行った。(A)サンガーシークエンスによる標的部位でのEGFPノックインの確認。(B)ホモ接合性ノックインを持つ4つのクローンの ジェノタイピングPCR。野生型遺伝子座は762bp、EGFPノックイン遺伝子座は3194bp。(C)顕微鏡によるノックイン細胞のEGFP蛍光。(D) 核型分析結果。 (E) 作製したEGFPノックインiPS細胞における多能性マーカーNANOG、OCT4、SOX2の発現を免疫染色法にて確認した。
ご注文方法
リソース
FAQ
遺伝子ノックアウトは、CRISPRによって引き起こされる二本鎖切断(DSB)後のエラーを起こしやすい非相同末端接合(NHEJ)を介したDNA修復によって生じます。その結果、フレームシフトや配列欠失(デュアルgRNAを使用した場合)といった変異が一定の頻度で起こり、標的遺伝子の機能破壊を誘発します。一方、遺伝子ノックインは相同組み換え修復(HDR)によるドナーテンプレートの標的部位への正確な挿入に依存しており、これはNHEJよりもはるかに効率が悪く、分裂細胞でのみ可能となります。さらに、HDRの効率は細胞の種類によって異なるため、遺伝子ノックインは遺伝子ノックアウトよりも技術的に難易度が高くなります。
ドナーテンプレートの選択で最も考慮すべきはその大きさになります。小さな配列(<10 bp)を導入する場合、HDRの効率が向上するssODNが一般的にHDRの効率が向上する最良の選択肢です。ドナーテンプレートが大きい場合は、環状プラスミド(細胞毒性は低いがHDR効率は低い)または直鎖状dsDNA(HDR効率は高いが細胞毒性が高い)を使用してください。
トランスフェクションおよび抗生物質の選択後、トランスフェクション陽性細胞のプールが得られます。血球計算版などで細胞を数え、細胞数と濃度を測定します。細胞プールを限界希釈することで、96ウェルプレートで1ウェルあたり1細胞未満になるようにまきこみ、培養します。増殖してきた個々の細胞クローンは、さらに培養して増やし、目的の遺伝子組み換えが起きているかを確認します。




