遺伝子ノックダウン細胞株
VectorBuilderは、目的遺伝子 (GOI) の長期的な発現抑制を必要とする実験のために、shRNAノックダウン安定細胞株作製を受託しています。GOIを効率的にノックダウンするために、3種類のshRNAをデザインし、それぞれをレンチウイルスベクターによって細胞へ導入します。ノックダウン効率はRT-qPCRで検証し、最も優れたノックダウン効果を持つ細胞株を納品いたします。完成細胞株を出荷する前には、無菌試験やマイコプラズマ試験などの一連の標準QCアッセイが実施されます。
特長
- 恒久的な挿入: レンチウイルスによるトランスダクションは、宿主細胞およびすべての娘細胞のゲノムへの安定挿入を可能にします。
- 幅広い感染指向性: VSV-Gレンチウイルスは、ほとんどの哺乳類細胞の表面レセプターに結合して、効率的な遺伝子導入が可能です。
- 高い発現抑制: 3種のノックダウンshRNAを使用し、最もノックダウン効率が高かった細胞株が納品されます。
- 短い作業日数: ベクター設計から最短8週間でノックダウン細胞を提供できます。
サービス詳細
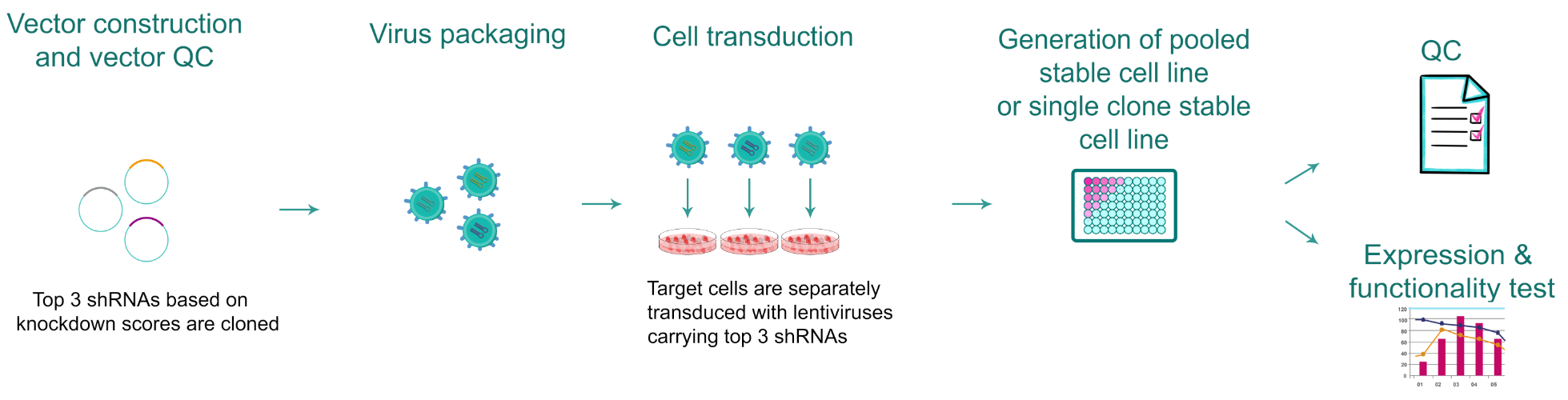
図1. 遺伝子ノックダウン安定細胞株作製のワークフロー。
価格と作業日数 プライスマッチ
| サービス内容 | 納品形態 | 価格 (税別、送料別)* | 作業日数 |
|---|---|---|---|
| 遺伝子ノックダウン | 細胞プール (>106 細胞/バイアル,2本) | 620,000円より | 8-11 週間 |
| 2 モノクローン (>106 細胞/バイアル,2本/モノクローン) | 697,500円より | 13-16 週間 |
* 追加のクローンまたはバイアルには追加料金がかかります。
QCアッセイ
| アッセイ内容 | 検査方法 |
|---|---|
| ノックダウン確認 (デフォルト) | RT-qPCR |
| 発現テスト (オプション) | WB, IF, FACS |
| 無菌試験 (デフォルト) | マイコプラズマテスト(PCR), バイオバーデン試験 |
解析の追加
ご要望に応じて、増殖、アポトーシス、遊走、生存率、細胞毒性などのアッセイを含む、樹立細胞株の様々な表現型評価や機能検証を実施いたします。
ケーススタディ
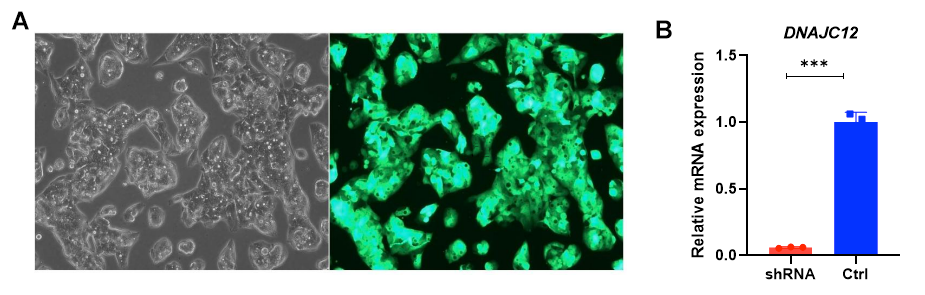
図2. Hep-G2細胞で達成された高いDNAJC12ノックダウン。(A)EGFPマーカーを持つDNAJC12 shRNAを導入したレンチウイルスを導入したHep-G2細胞の画像。(B)RT-qPCRによるノックダウン効率は90.9%であった。N=3;p値<0.001。
ご注文方法
リソース
FAQ
ベクタービルダー社はshRNAのデザインとスコア算出にRNAiコンソーシアム(TRC)の方法に類似した方法を採用しています。特定のRefSeqトランスクリプトに対して、標的配列の候補になりうるすべての21塩基配列を検索します。得られた候補のうちノックダウンの効率・特異性そしてクローナビリティを低下させると考えられる特長(同じ塩基が4つ以上連続する、G/Cが7塩基以上連続する、GC含有率が25%以下もしくは60%以上、そしてAAが5‘末端にある)を持つものを排除します。内部にステムループを含む、3‘末端にかけてのGC含有が高い、既知のmiRNAシード配列を含む、他の遺伝子に対してオフターゲットマッチが見つかるなどの候補にたいしてはノックダウンスコアにペナルティが課せられます。スプライシングバリアントを持つ遺伝子については、すべてのトランスクリプトに対して標的配列を持つ候補はより高いスコアが与えられます。
すべてのスコアは0以上で平均値は~5、標準偏差は~5で、95%が15以下のスコアとなります。ノックダウンスコアが約15のshRNAは理想的なノックダウン効率とクローナビリティを持つと考えられ、一方でスコアが0のshRNAはノックダウン効率にほとんど期待できず、ノックダウンクローンを得ることは非常に難しいでしょう。
ノックダウンスコアはあくまで目安であることにご注意ください。実際のノックダウン効率はスコアの予測から大きく外れる可能性もあります。スコアの低い標的配列もうまく機能するかもしれません。また、3’UTRを標的にすることは翻訳領域を標的とするときと同様に効果的である可能性があることをご留意ください。
目的遺伝子の働きを不活性化し、その影響を調べる目的ではshRNAノックダウンもCRISPRを使ったノックアウトのどちらも役に立ちます。目的に応じてどちらがより適しているかを判断するためのポイントを以下に記載します。
メカニズム
- ノックダウンベクター
ノックダウンベクターはshRNAという短いヘアピン状のRNAによって細胞の標的mRNAを分解、翻訳阻害することで目的遺伝子の機能を抑えます。そのため、shRNAノックダウンベクターは標的遺伝子配列を変えることはありません。
- ノックアウトベクター
CRISPRはヌクレアーゼにゲノム上の標的配列を切断するように働きかけます。分解された配列が不完全な形で修復され結果、配列の挿入もしくは欠損が起こり、恒久的な変異となります。それらの変異のいくつかは翻訳コドンのずれ(フレームシフト)やストップコドンを作り出し、標的遺伝子の機能不全を引き起こします。ゲノム上で数kb以内にふたつの標的配列が同時に切断された場合は、その間の配列に欠損が起こることもあります。
効率
shRNAノックダウンは最も効果的なshRNAをつかったとしても、標的遺伝子の発現を100%抑制することはできません。一方でCRISPRの場合、遺伝子の機能を完全に欠損させる変異を持つ細胞を作成できます。
再現性と均一性
一般的にshRNAベクターは、処置を施した細胞プール内のほとんどの細胞から均一な結果が得られ、複数の実験の間で高い再現性が得られます。一方でCRISPRは変異が偶発的に引き起こされるので、得られる結果が細胞によって違います。細胞の標的遺伝子を完全に欠損させるためには細胞内のすべての遺伝子コピーを破壊しなくてはなりません。X-またはY-染色体上の遺伝子を除いて大抵の細胞は遺伝子が2コピーあり、そしてがん細胞は2コピー以上の遺伝子を持つので遺伝子を完全に欠損させた細胞が得られる可能性はとても低くなります。このような理由から、CRISPRのようなヌクレアーゼを利用した遺伝子ノックアウトはすべての標的遺伝子コピーが破壊された細胞をDNAシークエンスによって特定する必要があります。
オフターゲット効果
オフターゲット効果はshRNAノックダウンでもCRISPRノックアウトでも報告されています。観察された表現型がオフターゲット効果であるかどうかは同じ標的遺伝子に対して異なる複数のshRNAを使うことで確認できます。もし、異なる複数のshRNAノックダウンから得られた表現型が同じならば、その表現型はオフターゲット効果ではない証拠となります。CRISPRノックアウトを使う場合は、オフターゲット効果による表現型でないことを確認するために標的遺伝子に対して異なる機能欠損変異を持つ複数のクローンを作成して解析する必要があります。加えて、得られた変異体クローンのゲノムから、バイオインフォマティクスによって推測されるオフターゲットとなりうる配列をシークエンスして、それらに変異がないことを確認する方法もあります。




