ワクシニアウイルス (VACV)
組み換えワクシニアウイルスはカルタヘナ法令の大臣確認実験に相当します。使用前に第二種使用等拡散防止措置確認申請が必要となりますので、ご注意ください。
組換えVACVには、大きな搭載容量(25-30kb)、広いトロピズム(指向性)、宿主の機能を使わずに複製可能など、いくつかの利点があります。近年では、ワクチン開発や腫瘍溶解療法など、幅広い臨床応用が期待されています。VectorBuilderでは、VACVベクターのクローニングおよびパッケージングサービスを提供しており、in vitro、in vivoのいずれの研究にも適しています。
ご提供しているVACV関連サービス
- VACV BACYACバックボーンを用いた、弱毒化したWestern Reserve(WR)株およびModified Vaccinia virus Ankara(MVA)株用のVACVベクタークローニング
- VACV ウイルスパッケージング
サービスの詳細
VACV BACYACベクタークローニング
VectorBuilderでは、VACVベクターをクローニングするために独自のBACYACバックボーンを開発しました。このバックボーンは、バクテリア人工染色体(BAC)と酵母人工染色体(YAC)のキーとなる要素を組み合わせたものです。BACの要素は大腸菌内でBACと同様の扱いを可能にし、YACの要素は酵母(Saccharomyces cerevisiae)内での扱いを可能にします。故に、BACYACバックボーンはユーザーに大腸菌と酵母のどちらでも増幅したり、改変したりすることを可能にし、実験方法の選択の幅を広げます。BACYACバックボーンはLacZまたはEGFPレポーターと共にご提供しており、導入された細胞を容易にレポーターを指標に同定することができます。
EGFP/LacZレポーター遺伝子、BACYACバックボーン、そしてワクシニアプロモーターをワクシニアTK(チミジンキナーゼ)遺伝子とJ2Rサイトの間に挿入し、弱毒化組換えベクターをご提供しています。MVA株と弱毒WR株は、基礎研究、前臨床、臨床の場で使用できます。 当社では、さらに弱毒化されたウイルスを指向性突然変異によって生産することも可能です。
図1に当社のVACV BACYACベクターの基本的なデザインを示します。
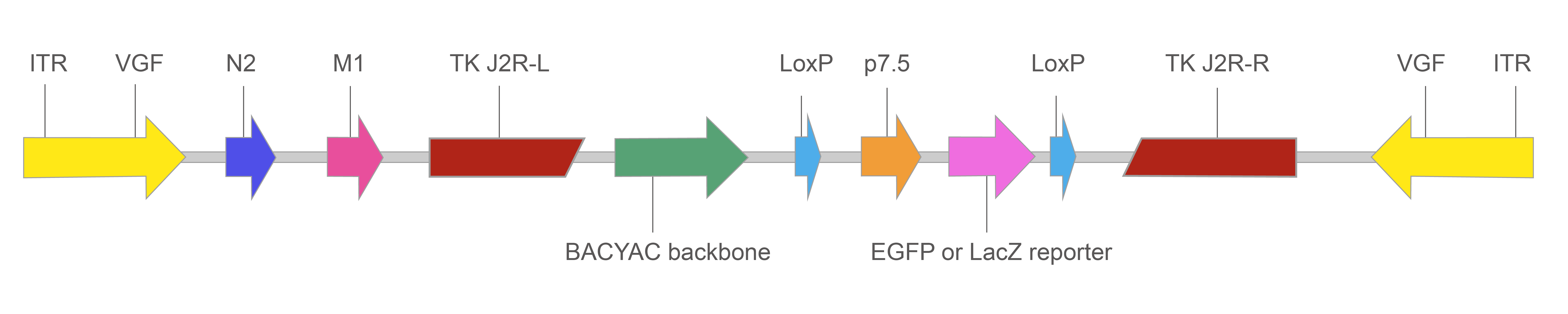
図1.EGFP/LacZレポーターを持つ組み換えVACV BACYACベクターの構成
TK: 組み換えVACVでは弱毒化するために不活化されたチミジンキナーゼ遺伝子。
p7.5: ワクシニアプロモーター。本ウイルスは細胞質内で複製するため、ワクシニアプロモーターが必要となる。p7.6はウイルスの転写の初期と後期に活性のあるプロモーターで、遺伝子導入の際によく使用される。
LoxP: Creリコンビナーゼの組み換えサイト。Cre存在下で、2つのloxPサイトに挟まれた部分は切除される。
ITR: 末端逆位配列(Inverted terminal repeats)。ワクシニアゲノムを挟むリピート配列でVGF (viral growth factor) 遺伝子を含む。
N2: 宿主の免疫反応を阻害する感染初期に発現する遺伝子。
M1: 宿主細胞のアポトーシスを抑制し、ウイルス生産を促進する遺伝子。
EGFP or LacZ reporter: EGFPまたはLacZはCMVプロモーターによって駆動。レポーターの発現により、感染細胞の同定を容易にする
BACYAC backbone: バクテリア人工染色体(BAC)と酵母人工染色体(YAC)バックボーン。ベクター増幅をクロラムフェニコール耐性を利用して大腸菌、またHis3栄養補助選択マーカーを利用して酵母の両方で行うことが可能。
VACV ウイルスパッケージング
価格と作業日数 プライスマッチ
| スケール | 推奨使用系 | タイター | 容量 | 価格(税別、送料別) | 作業日数 |
|---|---|---|---|---|---|
| パイロット |
培養細胞 |
>108 PFU/ml | 250 ul (10x25 ul) | 62,000円 | 21-28 days |
| 中容量 |
培養細胞 |
>108 PFU/ml | 1 ml (10x100 ul) | 263,500円 | 21-28 days |
| 超純粋中容量 | 培養細胞 & in vivo | >108 PFU/ml | 1 ml (10x100 ul) | 418,500円 | 21-35 days |
保存方法
当社のVACVはHBSSバッファーで保存され、ドライアイスで出荷されます。お受け取り後は、-80℃で長期保存(6ヶ月以上安定)、1週間以内に使用する場合は-20℃で保存可能です。VACVの保存期限は約1年です。 凍結融解を繰り返すと、力価が大きく低下することがありますので、お避けください。
技術的情報
VACV製造と品質検査(QC)
ウィルスパッケージング (図2)では、目的の遺伝子(GOI)を持つ非感染性のVACV BACYACプラスミドを哺乳類細胞にトランスフェクトし、非複製ファウルポックスヘルパーウィルスを感染させます。VACVは幅広い宿主細胞に感染することができるため、複数の細胞株を用いて組換えウイルスのパッケージングには複数種の細胞株が使用可能です。VectorBuilderでは、VACVのレスキューと増幅に異なる細胞株を使用してウイルスのストックを作製しています。VACVのレスキューと増幅のステップに続いて、プラーク精製により、ウイルスクローンを確立・保存し、その後さらに増幅します。細胞外のエンベロープウイルス(EEV)と細胞内の成熟ウイルス(IMV)の両方を、それぞれ上清と細胞溶解液から採取します。EEVはPEG濃縮され、IMVと混合します。超純粋VACVの場合、ウイルス粒子はショ糖密度勾配遠心法により、さらに精製します。
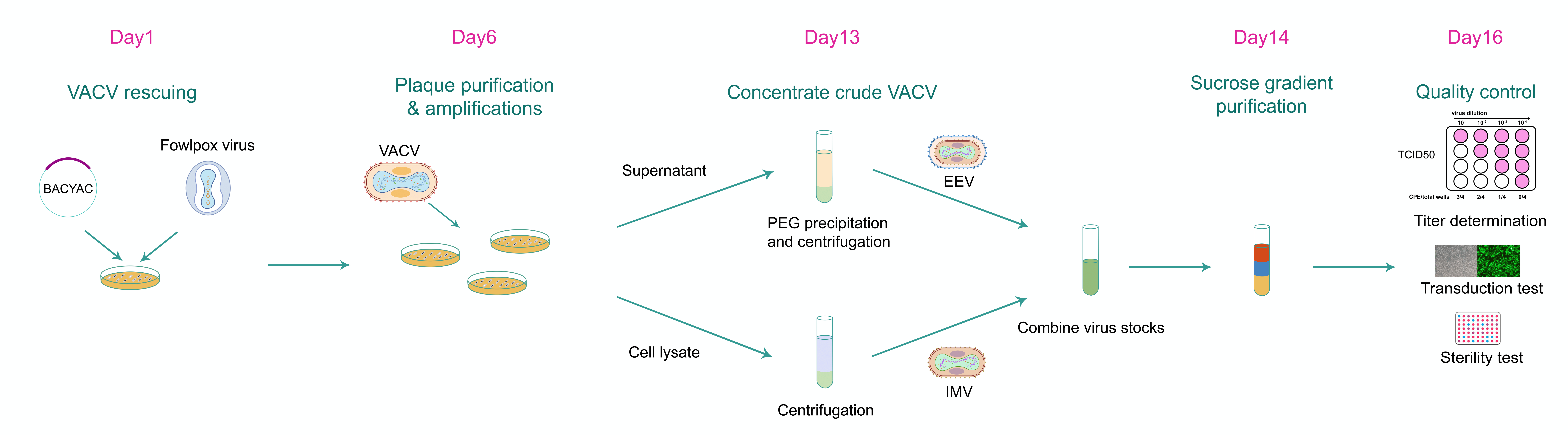
図2. BACYACベクターからのVACVパッケージングのワークフロー
VectorBuilderで製造された各組換えVACVについて、品質管理にはタイター測定、細菌および真菌の無菌試験、マイコプラズマ検出試験が含まれます。VACVベクターが蛍光タンパク質や薬剤選択マーカーをコードしている場合は、トランスダクションを行い、それぞれ蛍光検出や薬剤選択により発現を確認します。さらに、超純粋VACVについては、エンドトキシンレベルを確認するために、エンドトキシンアッセイを定期的に実施しています。エンドトキシンアッセイの結果をCOAに含めたい場合は、追加費用が必要です。また、ご要望に応じて、追加のQCサービスをご提供することができます。
実験による検証
当社の成熟VACVは完全に検証し、BHK21細胞株への導入が可能であることが示されています(図3)。
導入前
導入後
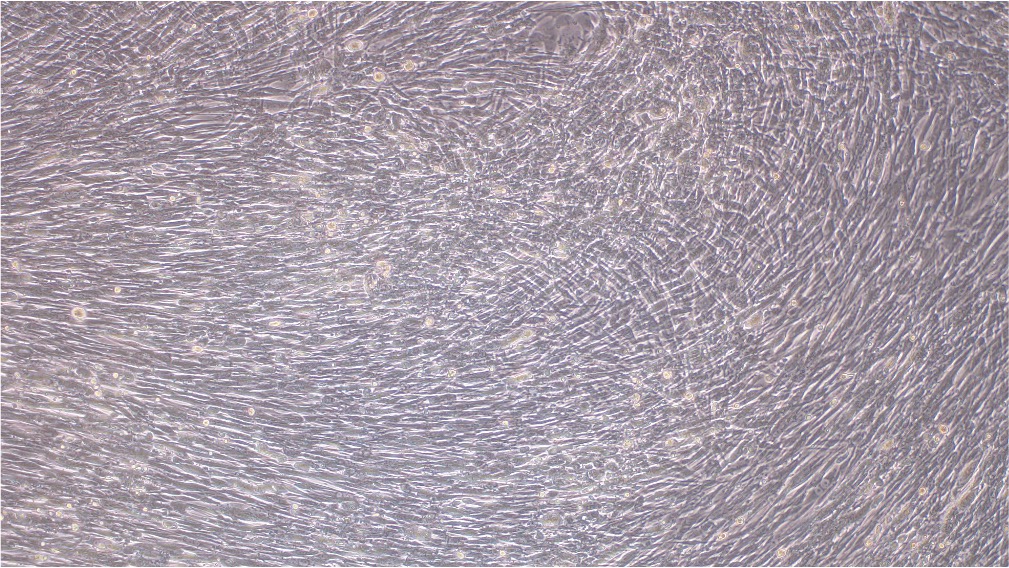

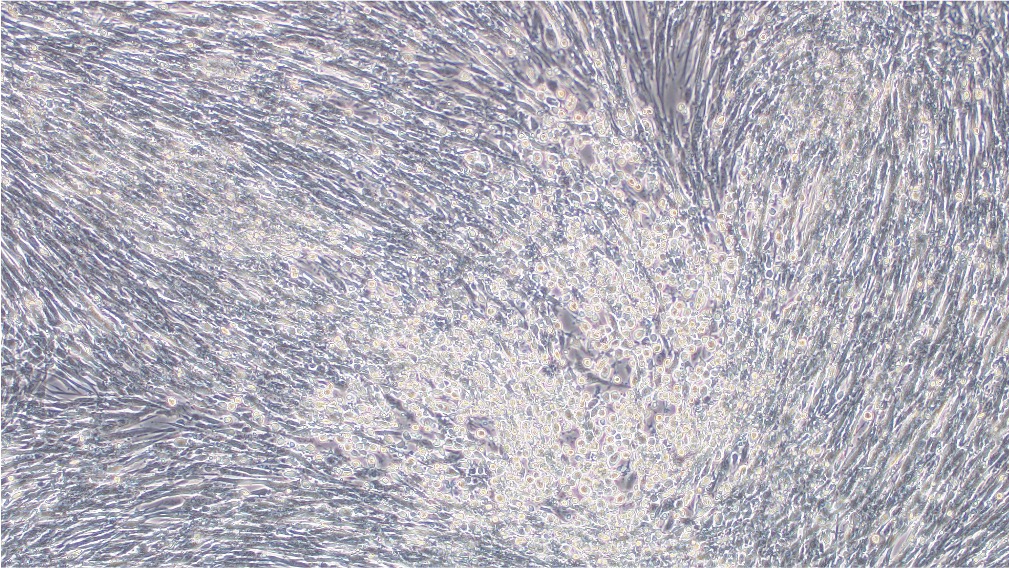
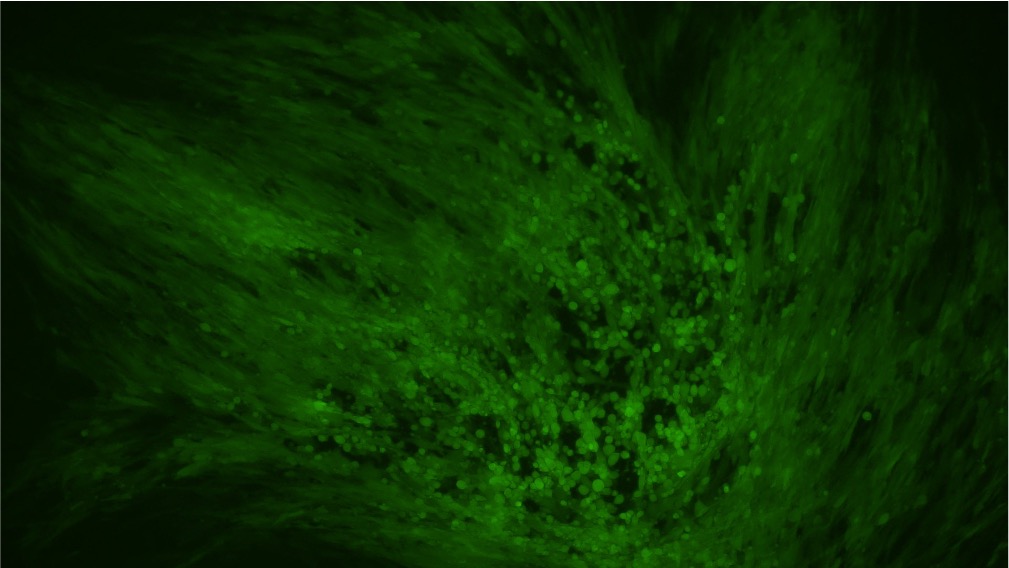
図3.EGFPレポーターを搭載するBACYACベクターにて作製したVACVをBHK21細胞にMOI 0.5にて感染させた。画像は導入後0時間と72時間後に撮影。倍率:100x 左:明視野、右:EGFP
ワクシニアについて
VACVは、ポックスウイルスファミリーに属する2本鎖の直鎖DNAウイルスです。そのゲノム長は約190kbで、大きな導入遺伝子(25〜30kb)を組み込むことができます。ウイルスの複製と転写は全て宿主細胞の細胞質で行われ、ウイルスゲノムにはDNA複製とRNA転写に必要な全てのタンパク質がコードされています。従って、ウイルスのライフサイクルにおいて、宿主細胞の機構に依存することはほとんどありません。
ウイルスのライフサイクルの初期段階では、多くの免疫調節タンパク質が産生され、ウイルスが宿主の自然免疫系から逃れるのを助けています。成熟したVACVには、細胞溶解時に放出される細胞内成熟ウイルス(IMV)と、エキソサイトーシスにより細胞外に放出される細胞外エンベロープウイルス(EEV)の2つの主要な形態があります。これらの形態はいずれも、脂質膜と宿主細胞膜の融合によって宿主細胞に感染することができ、感染に宿主細胞表面の受容体との結合が必要としません。
VACVの主な用途
組換えVACVベクターは、様々な遺伝子治療用途に使用されています。良好な安全性プロファイル、大きな外来遺伝子を搭載できること、広範な宿主細胞に感染可能なこと、ウイルス自体の免疫標的化を防止しながら宿主免疫応答を強化することなど、多くの利点があり、有望なシステムとされています。
ワクシニアファミリーの中でも、感染力や複製能力が異なる様々な株が開発されており、臨床応用に影響を及ぼしています。特に汎用されている2つの株は、WR株とMVA株です。MVAはその減衰性から臨床現場でより頻繁に使用されているが、WRは複製速度が速く、宿主の免疫系をより高度に変調させることができます。現在、両株とも基礎研究および臨床研究の両方で広く使用されています。以下に、VACVが使用されている主な研究分野の一部を紹介します:
がん治療
VACVは、がん細胞を溶解する直接的な効果に加えて、免疫細胞をリクルートしてサイトカインを分泌させ、間接的に抗腫瘍免疫応答を引き起こすことによって、腫瘍の微小環境を変化させることができます。ウイルス本来の利点を維持しながら安全性と有効性を高めるために、特異的な遺伝子改変が行われています。例えば、オンコリティック(腫瘍溶解性)ウイルスであるPexa-Vecは、TK遺伝子を欠失させることにより弱毒化され、さらに宿主の免疫反応を高めるためにGM-CSF遺伝子を導入・発現するようにしています。この治療法は、様々な固形がんを対象とした臨床試験で検証されています。この他にも、いくつかの腫瘍溶解性VACVの臨床試験が進行中であり、腫瘍溶解療法のシステムとして、VACVが急速に成長していることが注目されています。
ワクチン開発
VACVは、外来抗原を導入するための有望なプラットフォームです。DNAの搭載可能な容量が大きく、天然痘の予防接種に広く使用されてきたことから、HIVや狂犬病など、さまざまな病原体に対するワクチン構築のための理想的な候補として確立されています。
遺伝子治療におけるVACVの利点
広範な指向性: VACVは細胞に感染するにあたり、特異的なレセプターを必要としないので、多くの細胞種に感染することが可能です。
ゲノムへのインテグレーションリスクが低い: VACVのライフサイクルは8時間と短く、ウイルスの複製は終始細胞質内で行われることから、ウイルスDNAの宿主ゲノムへのインテグレーション(挿入)リスクはほとんどないに等しい。
腫瘍細胞における有効性: VACVは選択的に腫瘍細胞に感染および高効率に複製するように設計することができ、腫瘍細胞の溶解へと導くことが可能です。
独立したウイルス複製: 宿主細胞にほとんど依存せずにmRNA転写を行うことができるため、宿主細胞の環境変化に影響されません。
宿主免疫を回避(宿主抵抗性): VACVは、宿主の白血球に結合して不活性化するVaccinia補体制御タンパク質の分泌や、宿主由来のエンベロープに包まれた細胞外のウイルス形態の利用により、宿主免疫系を回避することができます。そのため、VACVは様々な投与方法により、腫瘍を含む遠隔組織をターゲットに導入することが可能です。
搭載スペースが大きい: VACVは許容できるゲノムサイズが大きく、30 kb までの外来遺伝子を含むことが可能です。
高いウイルスタイターと感染能: VACVベクターはウイルスパッケージング効率が高く、高いタイターが得られます。また、感染力が強いことから、MOIは低めでも十分な導入が可能です。
発注方法
リソース
FAQ
VACVには他と比較して明らかなメリットが複数あります。搭載遺伝子サイズの大きさ、分裂、非分裂ともに様々な細胞を標的とできること、宿主免疫システムの回避能、細胞質のみで起こるウイルス複製、ゲノムインテグレーションのリスクを最小化し、宿主機能への依存が少ない、などの明確な利点を有しています。他のウイルスとの比較は以下の通りである。
| レンチウイルス | MMLV | アデノウイルス | AAV | VACV | |
|---|---|---|---|---|---|
| 指向性 | 広範 | 広範 | 細胞種によっては非感染 | セロタイプによる | 広範 |
| 搭載サイズ | 6.4 kb | 5.5 kb | 7.5 kb | 4.2 kb | 25-30 kb |
| 非分裂細胞に感染可能か? | Yes | No | Yes | Yes | Yes |
| 発現はインテグレーションされ安定か、または一過性か | 安定発現 (ゲノム挿入) | 安定発現 (ゲノム挿入) | 一過性 (エピソーマル) | 一過性 (エピソーマル) | 一過性 (エピソーマル) |
| ウイルスタイター | 高い | 中程度 | 非常に高い | 高い | 高い |
| プロモーターのカスタマイズ | Yes | No | Yes | Yes | No |
| 主な用途 | 培養細胞および in vivo | 培養細胞および in vivo | In vivo | In vivo | 培養細胞および in vivo |
| in vivoにおける免疫原性 | 低い | 低い | 高い | 非常に低い | 高い |
VACVベクターはそのままでは生ウイルスを作製することはできませんが、野生型ポックスウイルスを感染させたパッケージング細胞を用いて生ウイルスを作らせることは可能です。VectorBuilderでは高いタイターで、安全かつ効率的にパッケージングできるようパッケージング方法を最適化しています。
VACVを扱うにはバイオセイフティーレベル2の設備が必要です。




