LNPカプセル化
ベクタービルダーは、高いカプセル化効率と均質性の高いLNPを実現する、RNAおよびプラスミド送達のための脂質ナノ粒子(LNP)カプセル化サービスを提供しています。LNP製剤の最適化によって送達効率を高めることや、特定組織を標的とする抗体をLNPに結合させて特定の組織を送達標的とすることも可能です。LNP-RNA治療薬の大規模製造についてはCDMOサービスをご覧ください。
担当者に相談
特長
- 標準処方(SM102、ALC-0315、MC3など)およびカスタム処方が可能
- mRNA、saRNA、siRNA、Cas9 mRNA/sgRNA mix、circRNA、pDNAなど、さまざまなタイプのRNA/DNA分子をカプセル化可能
- 高いカプセル化効率 (up to 100%)
- 低い多分散性指数(PDI) (<0.1)
- 抗体結合LNPが利用可能




IVTベクター
デザイン & クローニング
デザイン & クローニング
IVT RNA製造
LNPカプセル化
品質管理(QC)
機能検証
詳細については 治療用IVT RNA開発 か、LNP-RNA製品 をご覧ください。
品質管理(QC)
ベクタービルダーはRNAおよびプラスミドのLNPカプセル化についての包括的なQCを提供しています。
| 属性 | QCアッセイ | リサーチグレード | GMP-like |
|---|---|---|---|
| 外観 | 目視確認 | √ | √ |
| 濃度 | RiboGreenアッセイ | √ | √ |
| カプセル化効率 | RiboGreenアッセイ | √ | √ |
| 粒子サイズ | 動的光散乱(Zetasizer) | √ | √ |
| 多分散性指数(PDI) | 動的光散乱(Zetasizer) | √ | √ |
| 表面電荷(ゼータ電位) | 動的光散乱(Zetasizer) | √ | √ |
| カプセル化RNA安定性 | キャピラリーゲル電気泳動(CGE) | オプション | √ |
| エンドトキシン | キネティッククロモジェニック(KCA) | オプション | √ |
| pH | pH紙 | オプション | √ |
| 無菌性 | バイオバーデン試験 | オプション | √ |
LNP-mRNA QCデータ
- TEM
- PDIとゼータ電位
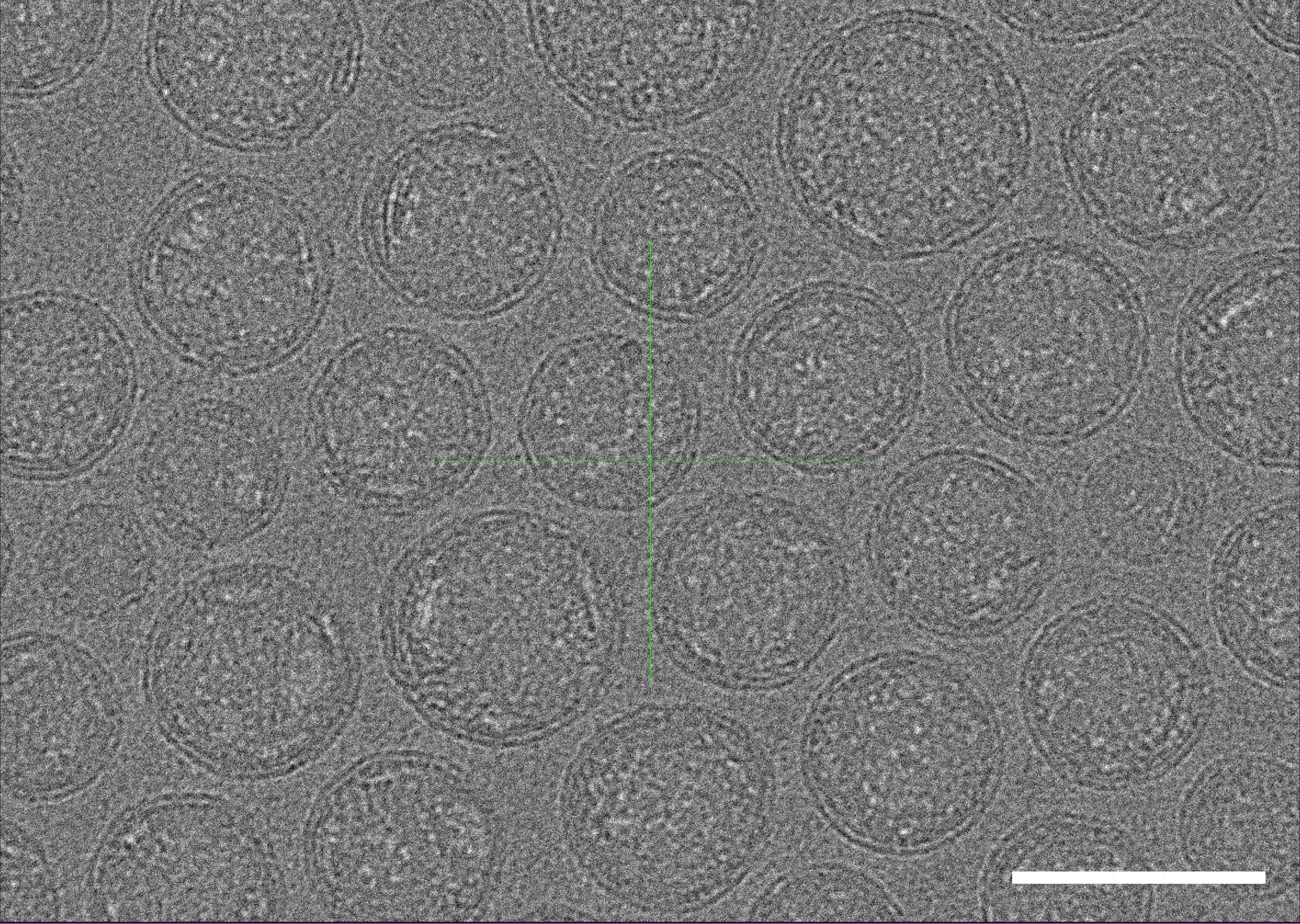
図1. LNP-mRNAの Cryo-TEM写真。スケールバー=100 nm
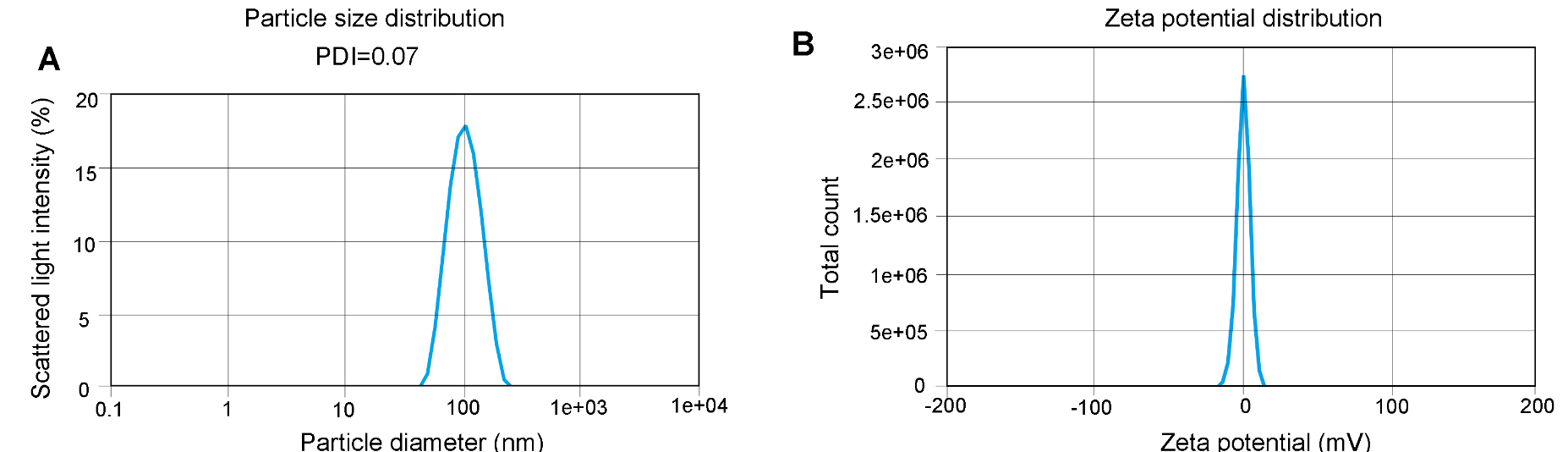
図2. 粒子径およびゼータ電位分布解析。PDI(A)とゼータ電位(B)は、粒子の運動による変動光の強度差を測定するDLSによって測定された。LNP混合物が均一であることを示している。
LNP-RNA機能検証
- LNP-mRNA発現 in vitro
- LNP-mRNA発現 in vivo
- 抗体結合LNP
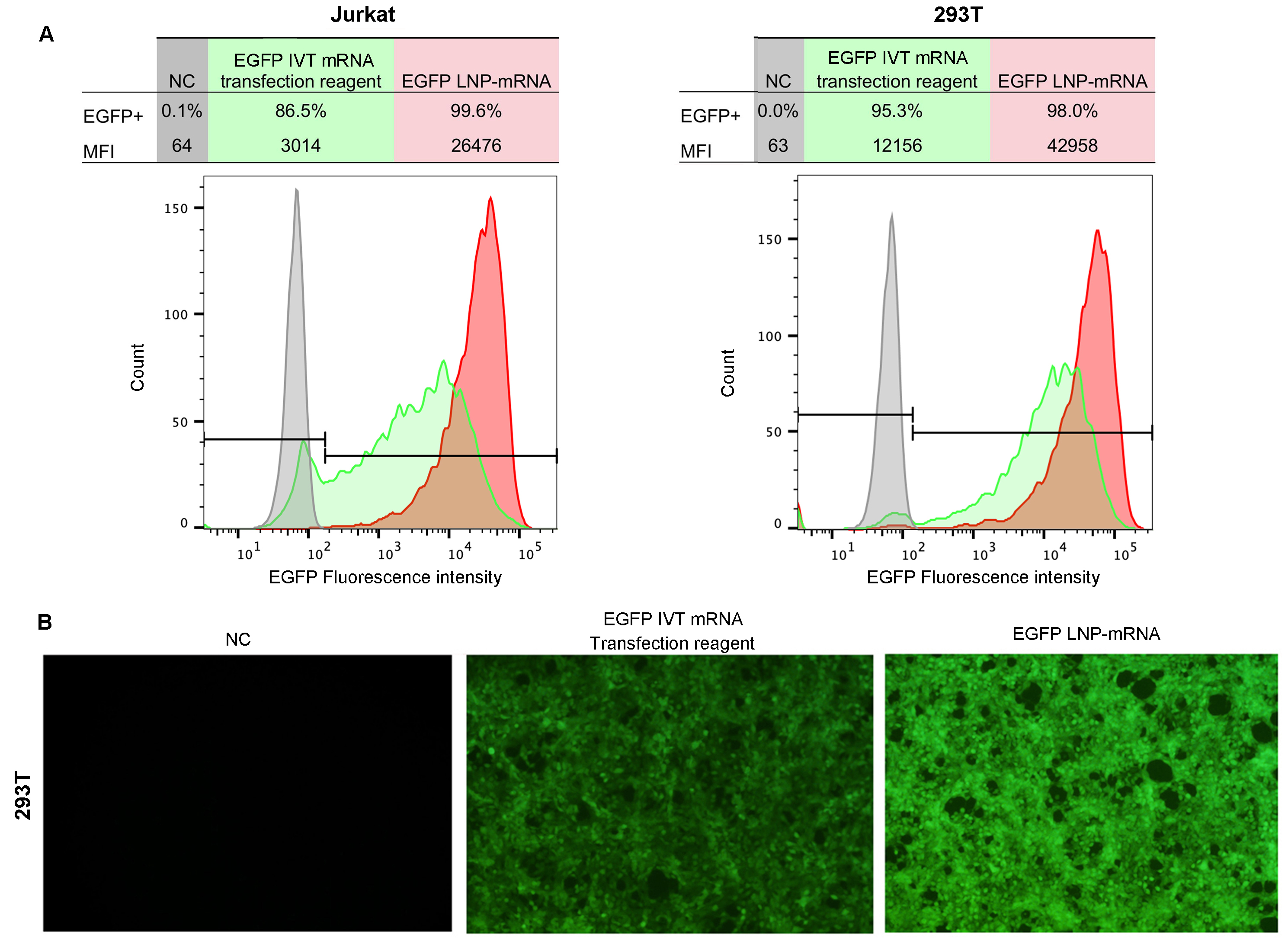
図3. in vitroにおける効率的なLNP-mRNA送達と遺伝子発現。LNPカプセル化EGFP mRNAあるいは市販のトランスフェクション試薬と混合したEGFP mRNAで細胞を処理した。(A)Jurkat細胞および293T細胞におけるEGFP発現のフローサイトメトリー結果。MFI:蛍光強度の中央値。(B)トランスフェクション後24時間のHEK293T細胞の蛍光像。
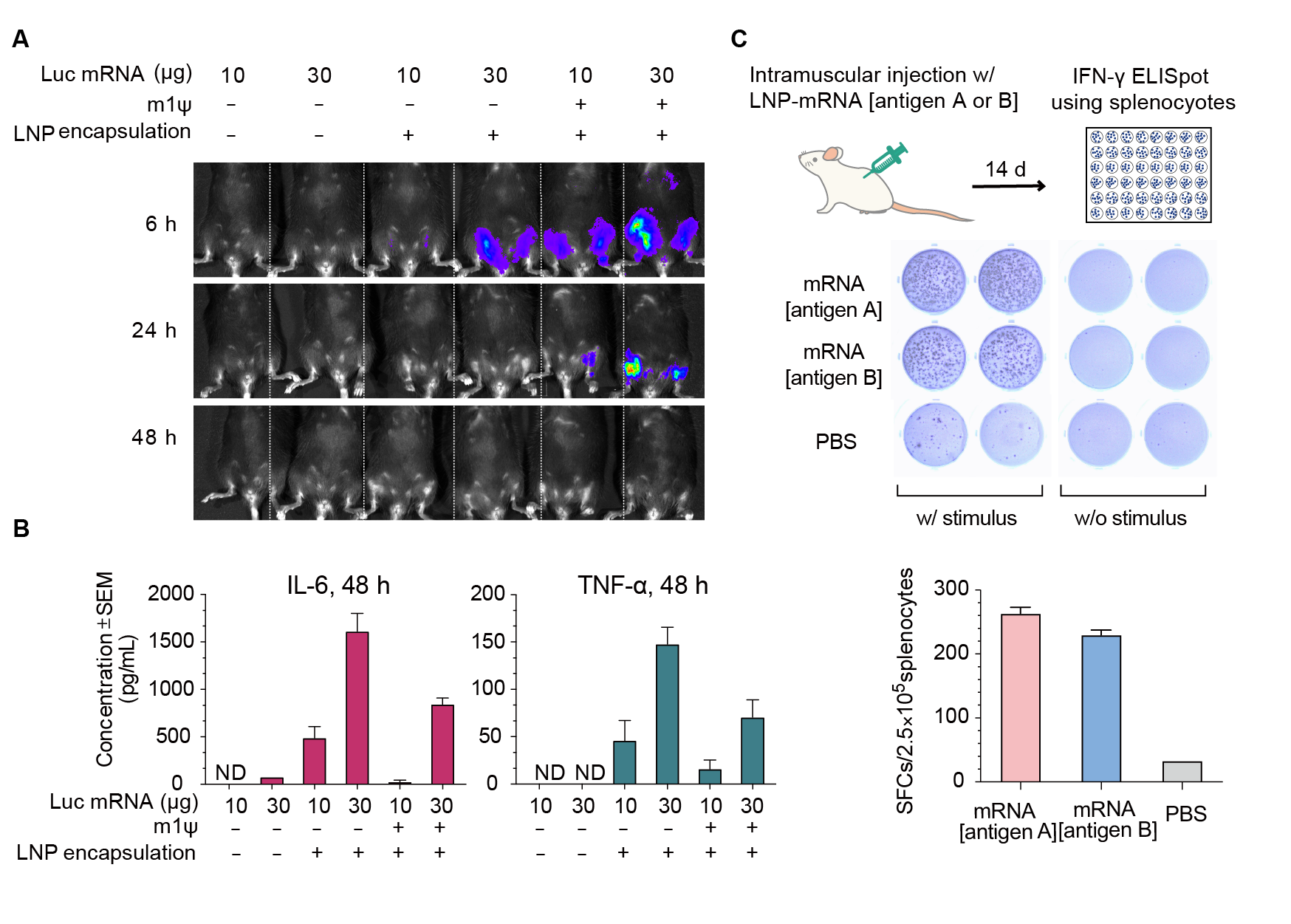
図4. マウスにおけるルシフェラーゼ(Luc)mRNAの発現とmRNAによる免疫反応。(A) インジェクション後6時間、24時間、48時間のライブイメージングによりルシフェラーゼ活性を可視化した。(B)インジェクション後48時間の血清中で2種の炎症性サイトカイン、IL-6とTNF-⍺を定量。エラーバーは標準誤差を表す。マウスの系統: C57BL/6J;マウス年齢:8週;インジェクション方法:筋肉内注射。(C)ウイルス抗原A、ウイルス抗原B、またはコントロールPBSをコードする30ugのLNPカプセル化mRNAを筋肉内注射14日後のBalb/Cマウス由来の脾臓細胞のIFN-γ ELISpotアッセイ。
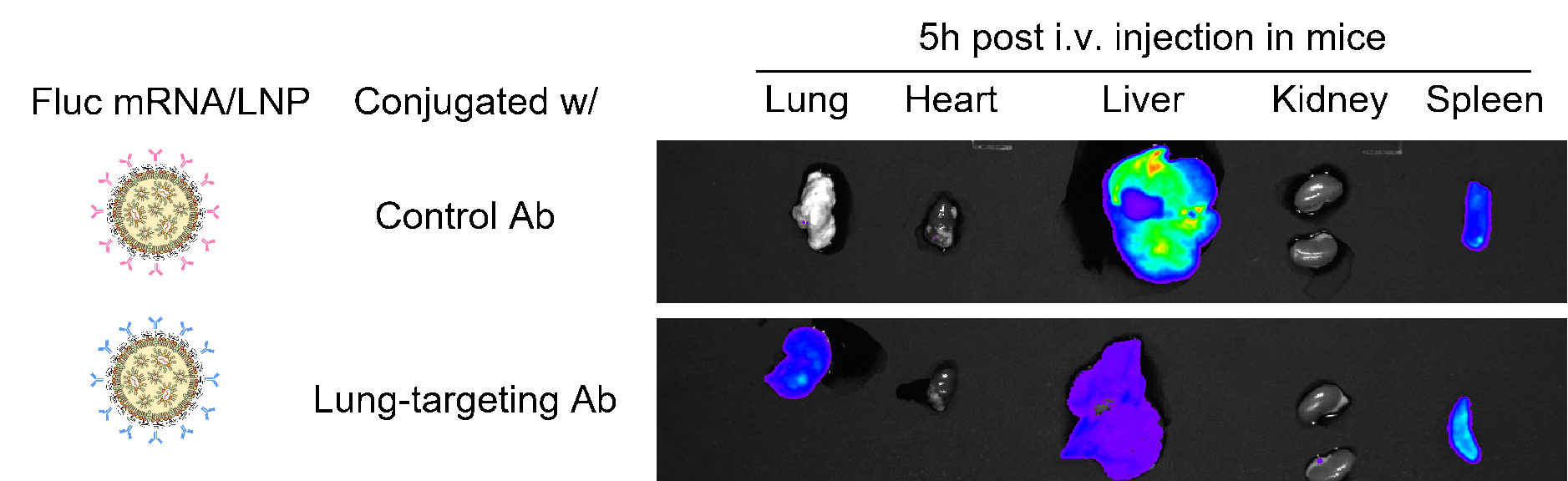
図5. 抗CD31抗体結合ホタルルシフェラーゼ(FLuc)LNP-mRNAは肺におけるルシフェラーゼ発現の改善を示した。マウスの系統 C57BL/6J;マウス年齢:6-8週;マウス性別:雌;投与経路:尾静脈。ネガティブコントロール:IgG2a標識FLuc LNP-mRNAおよび抗体結合無しFLuc mRNA。