単純ヘルペスウイルス(HSV)
組換え単純ヘルペスウイルス(HSV)は、最近、遺伝子治療および癌治療における有望なウイルスベクターとして浮上しており、神経系への遺伝子導入、腫瘍溶解剤、ガン、HSV, その他感染症に対するワクチンの開発など、さまざまな用途に利用されています。 HSVベクターは、自然の神経指向性、宿主細胞の生涯を通じて潜在的なエピソーム状態で存続する能力、および大きな外来遺伝子搭載能力などの利点が特長です。これらの特長のため、さまざまなin vitroおよびin vivoの遺伝子導入ニーズに理想的なウイルスベクターです。
VectorBuilderは、野生型ウイルスや弱毒化ウイルス、複製欠損アンプリコンなどの生ウイルスを再構成に使用できるHSVベクターのデザインと構築を受託サービスしています。また、リサーチグレードとGMPグレードの両方のHSVウイルスパッケージングサービスもご提供しています。
ご提供しているHSVの種類
VectorBuilderでは以下のHSV受託サービスを提供しています:
- HSVベクター構築:BAC またはBACYACバックボーン
- HSV-1 ウイルスパッケージング
- HSV-1 アンプリコンベクター構築
サービスの詳細
HSV BACYACベクター構築
VectorBuilderは、HSVベクターをクローニングするための独自の「BACYAC」バックボーンを開発しました。このバックボーンは、大腸菌の人工染色体(BAC)と酵母人工染色体(YAC)の両方の必須構成要素を組み合わせています。そのためHSVバックボーン上のBACエレメントは、ベクターがBACのように振る舞い大腸菌で増殖することを可能にし、かつYACエレメントは、ベクターがYACのように振る舞い出芽酵母(Saccharomyces cerevisiae)で増殖することを可能にしています。したがって、BACYACバックボーンは、大腸菌または出芽酵母のいずれかでHSVベクターを増殖および遺伝子改変する柔軟性をユーザーに提供しています。
BACYACバックボーンは、LacZまたはEGFPレポーターのいずれかを選択でき、レポーターの発現に基づいて感染細胞を簡単に識別できるようになっています。BACYACバックボーンは、Creを介した組み換えで、最終的にウイルスゲノムからの除去を容易にするために、一対のloxP部位を入れています。
ベクタービルダーのHSV BACYACベクターの基本的な構造は図11にイラストをご覧ください。
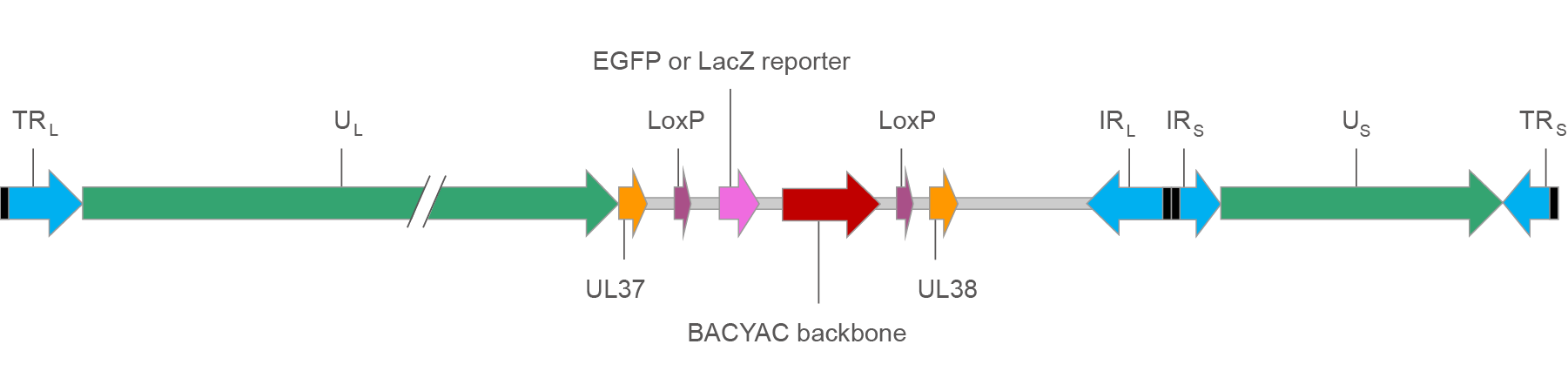
図1. EGFP/lacZレポーターを持つHSV BACYACベクターマップ
TRL/IRL: ユニークなLong segmentに隣接する末端領域および逆方向反復領域。この領域は「a」シークエンス(黒塗り)で囲まれ、4種のアイソフォームに対して組換えが起こります。
TRS/IRS: ユニークなShort segmentに隣接する末端領域および逆方向反復領域。この領域は「a」シークエンス(黒塗り)で囲まれ、4種のアイソフォームに対して組換えが起こります。
UL/US: HSV遺伝子をコードするユニークなLong segmentとshort segment.
UL37/UL38: HSV UL37 と UL38遺伝子。UL37 と UL38の間に外来DNAをクローニングすることで、HSVの病原性が変化します。
LoxP: Creリコンビネースの組み換えサイト。 Creの存在下で1対のLoxPサイトの内部シークエンスが除去できます。
EGFPまたはLacZレポーター: EGFP または LacZの発現 が CMVプロモーターによって制御されています。ウイルス感染細胞をレポーター遺伝子発現で容易に識別できます。
BACYACバックボーン:大腸菌人工染色体(Bacterial artificial chromosome:BAC) と酵母人工染色体(yeast artificial chromosome :YAC) バックボーン。HSVベクターの選択増幅をクロラムフェニコール耐性遺伝子を利用し大腸菌で、ヒスチジン合成酵素His3 選択遺伝子を利用し分裂酵母で行えます。
当社のHSV BACYACベクターは、HSV-1(17、FおよびKOS系統)およびHSV-2(HG52系統)を含む野生型株を揃えています。また当社が提供するHSVベクターまたはユーザーが提供するベクターの BAC編集 による変異誘発サービス(点突然変異、欠失、または挿入)の受託サービスをご提供しています。ウイルス複製に必須の遺伝子に欠失/変異を持つHSVゲノムを含むBACは、複製欠型HSV構築に使用できます。非必須遺伝子に欠失/変異を持つHSVゲノムを含むBACは、弱毒化HSV構築に使用できます。
HSVウイルスパッケージング
価格と作成作業日数 プライスマッチ
| スケール | 推奨使用系 | タイター | 容量 | 価格(税別、送料別) | 作業日数 |
|---|---|---|---|---|---|
| 超純粋パイロット | 培養細胞 & in vivo | >107 PFU/ml | 1 ml (10x100 ul) | 325,500円 | 28-35日 |
| 超純粋中容量 | >108 PFU/ml | 480,500円 |
出荷形態と保存方法
当社のHSVは、HBSSバッファーに保存されてドライアイス梱包で出荷されます。お受け取り後は、長期保存は -80°C (最短でも6か月安定)または短期1週間でしたら-20°Cで保存をしてください。HSVの使用期限は約1年間です。HSVタイターの大きな低下を防止するために、HSVの繰り返しの凍結融解を避けてください。
HSVアンプリコンベクター構築
VectorBuildeがご提供する HSV-1 アンプリコンプラスミドは、ミニマムウイルスシークエンスとして、複製開始点 (oriS) パッケージングシークエンス(pac)と1つまたは複数の遺伝子を含んでいます。アンプリコンプラスミドは、ヘルパー機能の存在下で感染性を持つが増殖欠損型のウイルス粒子としてパッケージングされます。ヘルパー機能は、パッケージングシグナルのみ欠損した完全長HSV-1ゲノムを持つBACから提供されます。
HSV-1アンプリコンベクターの基本デザインを図2に示します:
図2. HSV-1 アンプリコンプラスミドマップ
プロモーター: 目的遺伝子の発現を制御するプロモーターをここに配置する。
Kozak: コザック共通シークエンス。コザックシークエンスは目的ORFの開始コドンの直前に配置する。コザックシークエンスは真核生物の翻訳開始促進に関与しているといわれている。
ORF: 目的遺伝子のopen reading frameをここに配置する。
BGH pA: 牛成長ホルモンポリアデニレーションシグナル。Bovine growth hormone polyadenylationこのシークエンス上流にあるORFの転写終結を促進する。
HSV-1 pac: 単純ヘルペスウイルスー1 パッケージングシグナル。ウイルスDNAのウイルス粒子内へのパッケージングに必要。
Ampicillin: アンピシリン耐性遺伝子。大腸菌内でのプラスミド増幅に必要。
pUC ori: pUC origin of replication. pUC複製開始点。大腸菌内での高コピー数のプラスミド増幅を担う。o
oriS: HSV-1 DNA複製開始。プラスミドDNAが、HSV-1ウイルス粒子にコンカテマーDNAとして増幅、パッケージングされる。
IE4/5: HSV-1 ICP22 とICP47 超初期遺伝子プロモーター。プロモーターの活性は、トランスに働くHSV-1テグメントタンパク質VP16に依存しています。このプロモーターは、下流のマーカー遺伝子のユビキタス発現と、近傍にあるoriS stimulating originの転写調節領域としても機能する。
Marker: EGFPまたはLacZ遺伝子をベクターが導入された細胞を可視化させる。
SV40 early pA: Simian virus 40 early polyadenylation signal.上流ORFの転写終結を促進する。
技術的情報
HSV製造と品質検査(QC)
HSVパッケージング(図 3)に示すように、目的遺伝子gene of interest (GOI)を含むBACYACプラスミドと Creプラスミドを、パッケージング細胞に共トランスフェクションします。次に非蛍光プラークを選択して、BACYACバックボーンが除去されたウイルスを精製します。選択したウイルスプラークはHSVの増幅用に新たなディッシュに撒かれたパッケージング細胞に加え、ウイルスを増やします。超純粋HSVの場合、ウイルスプラークはショ糖濃度勾配遠心にかけて精製と濃縮を行います。
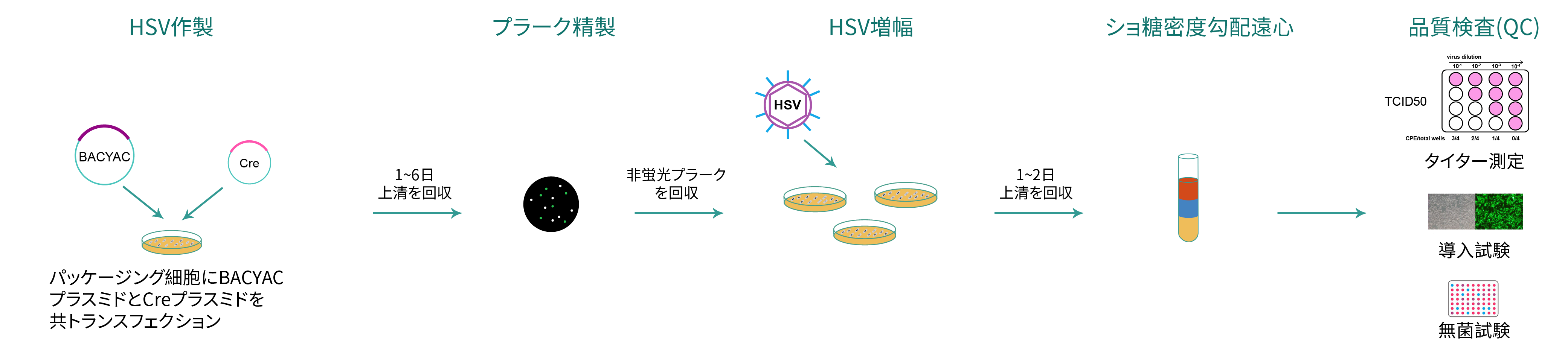
図 3. BACYACバックボーンが除去された BACYAC ベクターからHSVパッケージングを行うワークフロー
VectorBuilderによって製造された組換えHSVの品質管理では、タイター測定、細菌と真菌に対する無菌試験、マイコプラズマ検出試験に対して一定の合格基準を満たしたことを記載した品質結果を発行いたします。HSVベクターが蛍光タンパク質をコードする場合、対応する蛍光を検出するために形質導入テストを実行します。 HSV ベクターが薬物選択マーカーをコードしている場合、形質導入テストを実行した後、対応する薬物選択を行います。さらに、超純粋HSVウイルスについては、全てのウイルスに関して、エンドトキシン レベルをチェックして、合格基準を満たしたHSVを出荷いたします。
実験による検証
VectorBuilderのHSVベクターは、生ウイルスを産生できることが検証されています。 BACYACベクターを使用した野生型HSVウイルス粒子のパッケージングの成功例と、それに続く標的細胞への形質導入の例を、それぞれ下の図4と図5に示します。
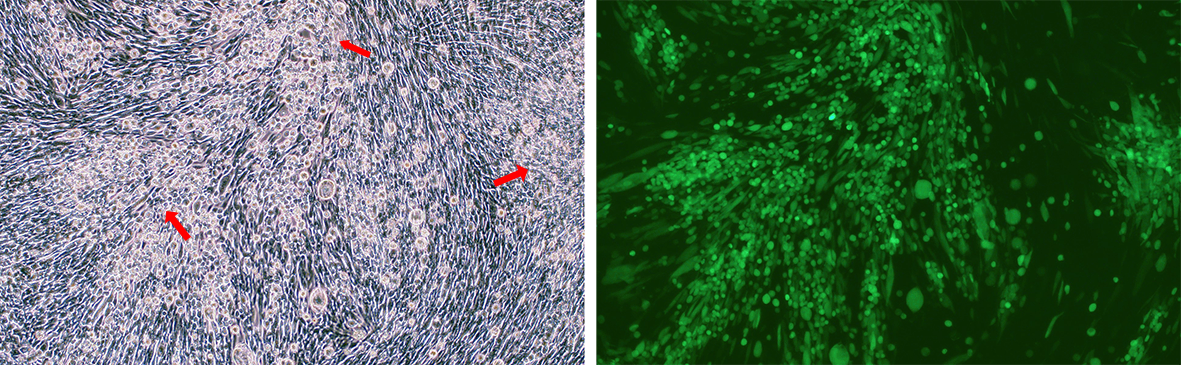
図4. EGFPレポーターをクローニングした野生型HSV-1(KOS株)の全ゲノム配列を運ぶBACYACベクターをBHK21細胞にトランスフェクトした。画像はトランスフェクション後72時間に撮影した。細胞変性効果(CPE)の兆候、すなわち、丸い形態と増加した光屈折(赤い矢印で示されている)を持つ細胞死を起こしている細胞の塊が観察でき、生きているウイルスの存在を示している。倍率: 100x. 左: 明視野細胞像。右: GFPを形質導入した細胞像を暗視野で蛍光顕微鏡下で撮影。
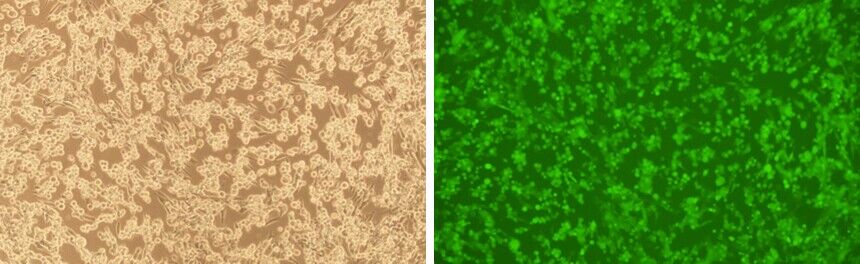
図5. ベクタービルダーで作製したHSV粒子を使いBHK21細胞に形質導入実験を行った。HSVは、EGFPレポーターをクローニングした野生型HSV-1(KOS株)の全ゲノム配列を運ぶBACYACベクターに由来する。画像はトランスダクション後96時間に撮影した。倍率: 100x. 左: 明視野細胞像。右: GFPを形質導入した細胞像を暗視野で蛍光顕微鏡下で撮影。
HSVの遺伝子治療に対する利点
HSVはエンベロープを持った二本鎖DNAウイルスで、遺伝子治療ベクターの有力候補です。 HSVベクターの主な利点を以下に説明します:
広範な指向性: HSVベクターでは、多種類の分裂および非分裂細胞に対して、容易に形質導入することができます。さらに、HSVは本来的に好神経細胞性で、逆行性軸索輸送を利用し接種部位から遠いのニューロンへに対して非常に効率的な遺伝子のデリバリーを行えます。そのためHSVベクターは特定の神経障害の遺伝子治療薬の開発に大変理想的なベクターです。
潜伏行動: HSVは、検出可能な悪影響なしに、感覚ニューロン内で潜伏状態を無期限に維持する能力を持っています。潜伏状態で存続する能力は、HSVが宿主免疫系を回避し、その生涯にわたって宿主細胞内で存続することを可能にします。長期的に安定した遺伝子発現をニューロンで研究するには、HSVベクターが適しています。
挿入型遺伝子変異のリスクを最小限に抑える: 潜伏感染を維持する場合、HSVは宿主ゲノムに組み込まれることなくエピソームに残ります。そのため挿入遺伝子変異のリスクが最小限に抑えられています。
組織培養で増殖する能力: HSVは組織培養で非常に簡単に増殖でき、さまざまな動物モデルで潜伏感染を確立することが示されています。
高いウイルスタイター: HSVベクターは高タイターでウイルスにパッケージングできるため、標的細胞を高効率に形質導入が可能です。
大きな外来遺伝子を搭載できる: HSVは80を超える遺伝子を含む大きなゲノムを持ち、そのうちのいくつかは複製に必須ではありません。これらの必須ではない遺伝子を削除し、大きな遺伝子または複数の遺伝子を発現させることが可能です。
よく使われるHSVベクター
HSVベクターは、大きく次のカテゴリに分類できます:
HSV BACベクター
HSV BACは、ウイルス許容性をもつ真核細胞で相同組み換えを介しHSVゲノムにBACバックボーン配列を組み込み構築されます。 EGFPなど選択マーカーがBACバックボーンにデザインされているため、BACバックボーン配列が組み込まれた組換えウイルスの単離が容易になります。ヘルペスウイルスのゲノムは、宿主細胞の核内で複製しながら環状化する傾向があり、複製中間体を生成します。この複製中間体を、大腸菌の形質転換用に分離します。 BACバックボーンに抗生物質耐性遺伝子がデザインされている場合、ウイルスBACを持った大腸菌の単離が容易になります。最後のステップでは、大腸菌からウイルスBAC DNAを精製し、制限酵素処理とサンガーシークエンシングでHSVゲノムとBACバックボーンシークエンスを確認します。シークエンスなどの規格に合格したHSV BACはウイルス許容性をもつ真核生物の宿主細胞にトランスフェクトし、生きたウイルスを生成します。
HSVはゲノムサイズが大きいため、HSVのクローニングに通常のプラスミドベクターを使用することはできません。一方、BACは、大きなDNA配列を保有する特長と、複製速度が遅いことで、HSV生態を研究するために適したベクターです。 HSV BACは、許容性をもつ細胞内でウイルスを保持した臨床用分離株を増殖させる場合と比較して、大腸菌でHSVを増殖させた方がウイルスゲノムシークエンスが安定性します。さらに、HSV BACの特長として、一般的な遺伝子工学技術を使用してHSVウイルスゲノムを非常に簡単に、かる正確に遺伝子操作し、目的とする変異ウイルスを構築する利点があります。
HSV BACには上に述べたようにいくつかの利点がありますが、次の遺伝学的な制限があり、定期的にチェックする必要があります。 HSVウイルスゲノムには反復配列があり、クローンをストックしている間に自然に欠失や重複などの変異が発生し蓄積する可能性があります。さらに、ウイルスゲノムにBACバックボーン配列を組み込んだ結果、ウイルスゲノムサイズが通常より大きくなっています、そのため、HSVウイルスの成長を阻害する可能性があります。したがって、HSV BACを操作するには、あらかじめBACバックボーンに隣接する領域に、loxPまたはFRTサイトを組み込むことをお勧めします。これにより、それぞれCreベースまたはFlpベースの組み換えによって、HSVゲノムへの目的の変異導入が完成した後、BACバックボーン配列を削除します。
HSVアンプリコンベクター
アンプリコンは、最小限のウイルス配列に加えて、目的とする1つ以上の遺伝子を含むHSV-1ベースのプラスミドです。HSV-1ヘルパーウイルスまたはトランスで供給されるヘルパー機能の存在下で、生きたHSVウイルス粒子にウイルスゲノムとしてパッケージングできます。クローン化されたHSV-1ゲノムのアンプリコンには、ウイルス起源の2種類のシークエンスのみが含まれます。パッケージング細胞でウイルス複製を可能にするoriS複製起点、そして生きたウイルスへのパッケージングを容易にするpacパッケージングシークエンスです。 HSVウイルス粒子は、野生型HSV-1と同様のローリングサークルメカニズムを介したアンプリコンゲノム複製によって生成されます。アンプリコンプラスミドの5’から3‘がタンデムに並んだコンカテマーとして生成されます。
アンプリコンベクターは、最大150 kbの大きなカーゴとしての搭載能力に加え、非常に簡単にクローンを作成できること、多種の細胞に形質導入できること、高い形質導入効率など、遺伝子導入ツールとして様々な利点があります。さらにウイルスタンパク質のコーディングシークエンスが無いため、アンプリコンベクターは形質導入された細胞や生物に対して完全に非毒性で非病原性になります。アンプリコンベクターにウイルス遺伝子がないことは、宿主細胞内でのウイルス潜伏期にウイルスゲノムの再活性化または組み換えの生じる可能性を最小限に抑えることにも役立ちます。
長い間、アンプリコンベクターに基づいた遺伝子導入の障害は、ヘルパーウイルスを含まない高タイターのアンプリコンベクターストックの生成でした。ヘルパーウイルスがコンタミしたアンプリコンストックは、潜在的な細胞毒性や炎症反応を引き起こす可能性があるため、遺伝子治療への応用には望ましくありません。ヘルパー機能を提供するために、重複するコスミドのセット、またはウイルスパッケージングシグナルのみを除去したHSV-1ゲノムを含んだBACベクターを利用するヘルパーウイルスフリーパッケージングシステムの開発は、この問題を大幅に克服することに役立ちました。これらの方法では、ほぼヘルパーウイルスを含まないアンプリコンストックの生成が可能ですが、高いウイルスタイターが得られません。そのため、ヘルパーウイルスのコンタミが低減された高タイターのアンプリコンストックを取得するための代替アプローチとして、Cre-loxテクノロジーを利用した方法があります。この方法では、ウイルス産生細胞内のヘルパーウイルスのパッケージングシグナルを除去します。しかし、この方法を使用して生成されたアンプリコンストックであっても、非常に低レベルのヘルパーウイルスがコンタミしている可能性を除去できないため、特定の遺伝子治療への使用には適さない場合もあります。
複製欠損型HSVベクター
複製欠損型HSVベクターは、ウイルス複製に不可欠な遺伝子の欠失または変異によって構築されます。複製欠損型HSVは、欠失したウイルス遺伝子をトランスに発現する細胞株を使って生成されます。これまでに報告されたほとんどの複製欠損HSVベクターは、ICP0、ICP4、ICP22、ICP27、ICP47などの感染細胞タンパク質(ICP)をコードする前初期(IE)遺伝子の欠失で構築されています。 ICPは、HSVが宿主細胞に入った直後に発現し、ウイルスゲノムの複製とビリオン構造の構築にそれぞれ不可欠なタンパク質をコードする一連の初期(E)および後期(L)ウイルス遺伝子の転写を開始します。したがって、IE遺伝子の欠失は、初期および後期のウイルス遺伝子発現を阻害します。
複製欠損型HSVベクターの最新バージョンは、複数のIE遺伝子の欠失で構成されています。そのため、少数のIE遺伝子欠失で構成された以前のバージョンと比較して細胞毒性が非常に低く抑えられています。新しいバージョンでは、複数の必須遺伝子とともに非必須遺伝子も欠失させることで、外来遺伝子を搭載キャパシティーを増やしています。これによって、複数の独立した遺伝子発現カセットをベクターに組み込むことが可能で、複数の導入遺伝子を同時に発現させる必要がある遺伝子治療の開発に適しています。
複製欠損型HSVベクターの主な欠点は、単一のIE遺伝子の欠失によって構成されたベクター認められる細胞毒性です。しかし細胞毒性の問題は、5種類のIE遺伝子すべてを欠失したベクターを開発することで大幅に低減されました。ただ、これらのベクターは培養細胞でのウイルス増殖が不十分で、導入遺伝子の発現レベルも低下することが示されています。したがって、適切な組み合わせで必須遺伝子を欠失させることは、複製欠損型HSVベクターを最適な条件で使うために考慮が必要です。複製欠損型HSVベクターの他の欠点は、欠失したウイルス遺伝子をトランスで発現できる細胞株が確立されているかどうかに依存していることです。
弱毒化HSVベクター
弱毒化HSVベクター(条件付き複製HSVベクターとしても知られる)は、in vivoでのウイルスと宿主の相互作用に関与する遺伝子など、in vitroでのウイルスの複製に必須ではない遺伝子の欠失または変異によって生成されます。したがって、弱毒化されたHSVは細胞培養で複製することができますが、特定の条件下でin vivoで複製することはできません。この特性を利用して、正常細胞では複製できないが腫瘍細胞では選択的に複製できるいくつかの弱毒化HSVベクターが、腫瘍溶解剤として開発されました。
弱毒化HSVベクターは、感染を容易に複製および拡散する能力があるため、非複製HSVベクターと比較して大幅に効率的な遺伝子導入を行える利点があります。さらに、弱毒化HSVベクターをウイルスワクチンとして使用すると、宿主の免疫系がすべてのウイルス抗原にさらされ、細胞性免疫と体液性免疫の両方が刺激されます。さらに、比較的容易に細胞培養でベクターを増殖させることができ、ワクチン開発を比較的経済的に進めることができます。
弱毒化されたHSVベクターの主な欠点は、複製能力を持つために発生する潜在的な安全上の懸念です。弱毒化HSVベクターに関連するリスクには、複製ウイルスのin vivoでのより病原性の高い株への突然変異または組み換え、ウイルスまたはその突然変異体が患者から他の人に広がる可能性、およびウイルスまたはその突然変異体が患者または発育中の胎児に病原性を持つ可能性です。弱毒化ベクターの他の欠点は、過剰に弱毒化される可能性で、その結果、ウイルスの有効性が大幅に低下することです。したがって、欠失または変異させる遺伝子を注意深く選択することは、目的の機能を備えた弱毒化ベクターを生成するために重要です。
HSVベクターの主な使用例
組み換えHSVベクターは、さまざまな遺伝子治療に使用されています。以下は、HSVベクターが使用されてきた主な研究分野を紹介します:
腫瘍溶解剤としてのHSVベクター
HSV-1ベクターは腫瘍溶解性ウイルス療法の有望な候補となっています。 HSV-1は感染性が高く、複製サイクル全体を10時間で完了して、数千の子孫ビリオンを放出しますアデノウイルスなどの他の一般的なウイルスにかかる時間と比較してはるかに短い時間です。 HSV-1ビリオンは、細胞外拡散に加えて、細胞間のジャンクション構造を介して細胞から細胞に拡散することができます。そのため固形腫瘍内で非常に効率的にウイルスの拡散が可能になります。さらにHSV-1はさまざまな実験動物に効果的に感染することが示されているため、in vivoの前臨床試験に非常に適しています。
正常細胞での増殖能を欠失させ、癌細胞を選択的に複製し殺すように設計された弱毒化HSVベクターは、腫瘍溶解ウイルスとして研究されています。このHSVベクターでは、正常細胞では必須であるが、腫瘍細胞には必要ないウイルス複製遺伝子を欠失させています。さらにベクターの抗腫瘍効果に改変を加え、抗腫瘍性または化学療法剤を活性化させる遺伝子を持たせることで、抗腫瘍効果をさらに増強することが可能です。タリモジェンラヘルパレプベック(TVEC)は、現在メラノーマの治療に使用されているFDA承認薬であり、腫瘍溶解性をもつ弱毒化HSV-1ベクターの一例です。 TVECは、正常細胞でのウイルス複製の阻害するICP34.5遺伝子と免疫系の活性化能をもつICP47を欠失させています。TVECの腫瘍溶解能は、樹状細胞の移動と成熟で免疫系をさらに刺激するヒト顆粒球マクロファージコロニー刺激因子(GM-CSF)をコードする遺伝子の過剰発現によってさらに増強されます。
弱毒化ベクターに加えて、複製欠損型HSVベクターもさまざまな癌治療に利用されています。これら利用は主に複製欠損型HSVベクターに、チミジンキナーゼ(TK)などの自殺遺伝子、または腫瘍細胞でTNF-αなど治癒遺伝子を、単独発現または組み合わせて発現させます。
ワクチンとしてのHSVベクター
HSVベクターの、ウイルスおよび細菌に対するウイルスワクチンとして利点は次の通りです:1)さまざまな感染ルートに応答して宿主生物に強力な免疫反応を誘発する能力、 2)宿主ゲノムに組み込まれることなく宿主細胞核内でエピソームとして存在する能力、 3)HSV-TK遺伝子を発現する細胞では、ガンシクロビルなど非毒性薬物を強い細胞毒性を持つ代謝物に変化させる。したがって、ウイルスに感染した細胞のみを死滅させることが可能です。 HSV-BAC、アンプリコンベクター、複製欠損HSVベクター、および弱毒化HSVを利用した研究はすべて、さまざまな病原体に対するウイルスワクチンとして使用した場合に有効な結果を出しています。
弱毒化HSVベクターは、宿主の免疫系をウイルス抗原に曝せるため、細胞性免疫と体液性免疫の両方を刺激できます。そのため抗HSVワクチンの開発に特に適しています。さらに、弱毒化生ワクチンは、不活化ワクチンまたはウイルスゲノムの特定のサブユニットのみを発現するワクチンベクターに比較して、より長期的かつ効果的な防御が可能です。世界人口のかなりの割合がHSV-1およびHSV-2に感染しているため、現在、どちらも治療できるFDA承認のワクチンがないことを考えると、抗HSVワクチンを開発する緊急性は高いといえます。ウイルス糖タンパク質gKおよび膜タンパク質UL20の部分的欠失によって開発された弱毒生HSV-1ベクターであるVC2は、HSV-1およびHSV-2感染の動物モデルで試験した場合、ワクチン候補として大きな可能性があることを示しました。
ウイルス複製の必須遺伝子が欠失し、特定の外来抗原を発現する複製欠損HSV変異体は、ウイルスおよび細菌感染のさまざまな動物モデルにワクチンとして投与すると、持続的かつ強力な免疫応答を誘発することも示されています。さらに、アンプリコンベクターは、マウスモデルを使用した多くの前臨床試験において、癌、微生物感染症、神経疾患に対する治療ワクチンとして申請されています。ただし、既存のHSV免疫を持つモデルを含む、他の動物モデルでの免疫原性の可能性を評価するには、さらなる研究が必要です。
遺伝子デリバリーツールとしてのHSVベクター
HSVアンプリコンベクターは、その自然な好神経性、大きな遺伝子搭載能力(<150 kb)、低い毒性、および標的細胞内でエピソームとして存在する能力のために、ニューロンの遺伝子デリバリーツールに特に適しています。そのため次の分野の研究に広く使用されています:1)アルツハイマー病やパーキンソン病などの神経変性疾患、 2)うつ病や中毒を含む神経精神障害; 3)急性虚血性脳卒中などの神経系の遺伝子治療です。さらに、多種多様な分裂細胞株に感染する能力と、プラスミドを使ったトランスフェクションと比較して、HSVアンプリコンベクターによる細胞への感染が比較的容易であるため、アンプリコンベクターはin vitroの薬理学的研究に非常に適しています。
複製欠損HSVベクターは、ウイルス複製の必須遺伝子を欠失させているため、細胞毒性を大幅に低下させることができます。そのため、遺伝子治療に対する遺伝子デリバリーベクターとしても使用されます。複数の遺伝子を削除することで、デリバリーに使える遺伝子搭載量も増加させられるため、複数の独立した遺伝子発現カセットをデリバリーできます。これは通常、多重遺伝子治療で使用されるベクターの要件です。したがって、複製欠損ベクターは、慢性疼痛、パーキンソン病、脊髄損傷、およびリソソーム蓄積症の動物モデルにおける遺伝子治療研究に広く使用されています。すでにヒトプレプロエンケファリン(PENK)を発現する複製欠損HSVベクターのNP2は、疼痛治療の第I相臨床試験で有望な結果を出しています。
ご注文方法
リソース
Q&A
HSVは自然に好神経性で、アンプリコンとして使用する場合は、最大150 kbの遺伝子積荷容量があります。さらに宿主細胞が生きている間、潜伏的状態を維持する能力を備えているため、他の一般的に使用されるウイルスベクター(レンチウイルス, アデノ随伴ウイルスAAV または アデノウイルス. )に比べていくつかの独自の利点があります。またHSVは宿主とする細胞の選択範囲が広く、さらに宿主ゲノムに組み込まれずエピソームとして維持されます。細胞培養で容易に増殖でき、高タイターのウイルスパッケージングです。
VectorBuilderは、HSV BACYACベクターとアンプリコンベクターの受託構築サービスを提供しています。どちらも生ウイルスの産生に使用でき、当社では広範なテストによって生ウイルスの産生を検証しています。HSV BACYACは、BHK21などのウイルス許容性をもつ真核生物宿主細胞株にトランスフェクトして、生ウイルスを産生することができます。アンプリコンベクターの場合、HSV-1ゲノムで欠損させている遺伝子を持つBACと、アンプリコンベクターを適切なパッケージング細胞に共トランスフェクションすることで生ウイルスを産生することができます。図4は、当社のベクターを使用した野生型HSV-1ウイルス粒子のパッケージングの成功例を示しています。
HSVベクターは通常、バイオセイフティーレベル2(BSL-2)の封じ込めで使用できます。ただし、バイオセイフティーポリシーは、施設ごとで異なる可能性があります。研究者は、所属機関に適用される適切なバイオセーフティガイドラインに従ってください。




