バーコードライブラリー構築サービス
ベクタービルダーは、実験において単一細胞または単一分子レベルでマルチプレックス解析を実行できる最先端のバーコードライブラリー作製サービスを提供します。バーコードライブラリーは、大腸菌グリセロールストック、プラスミドDNA、または組換えウイルスとして納品することができます。次世代シークエンス(NGS)による検証により、均一で偏りのないバーコードの存在率を保証しています。
特長
- 高い複雑性: 108までの複雑性を持つライブラリー構築を受託可能
- 高い均一性と偏りのないヌクレオチド分布
- 充実した技術サポート: 当社の経験豊富な科学者が、バーコードライブラリーデザインの最適化、バーコード合成とライブラリークローニングの最適なアプローチをサポート
サービス詳細
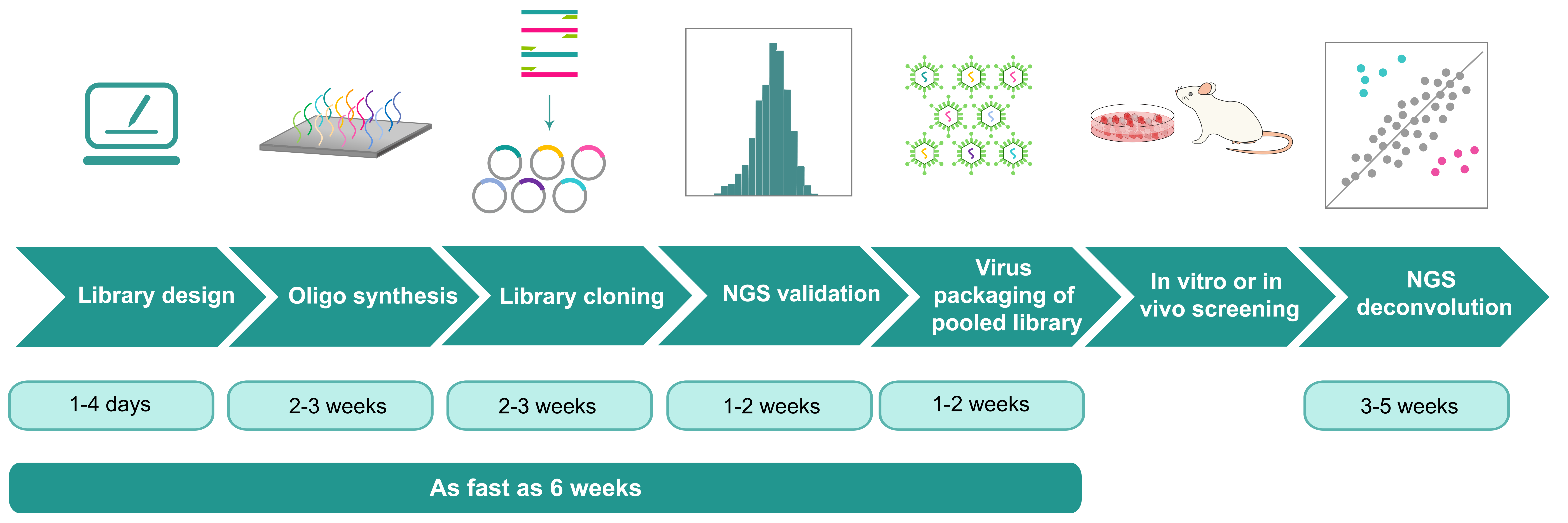
価格と作業日数 プライスマッチ
表1. 各サービスの価格と作業日数
| サービス | 概要 | 価格 (税別、送料別) | 作業日数 |
|---|---|---|---|
| ライブラリーの設計 | 遺伝子機能研究におけるロバストなハイスループットアプリケーションを可能にするために、108を超える複雑性を達成するバーコード配列、バーコード合成方法、ライブラリーベクターの設計、クローニング方法などの提案。 | 無料 | 1-4日 |
| プール型ライブラリーのクローニング | バーコード合成、ライブラリーベクターへのバーコードの大量並列クローニング、サンガーシークエンスによる予備検証、NGSによる完全検証を含む。納品物はライブラリーの大腸菌グリセロールストックとNGSレポートが含まれる。詳細は下記表2を参照 | ||
| プール型ライブラリーのウイルスパッケージング | ウイルスパッケージングサービスの詳細はこちらをご覧ください。ライブラリープラスミドのパッケージング価格は、通常のベクタープラスミドのパッケージング価格の1.5倍になります。 | ||
| スクリーニングサンプルのNGSデコンボリューション | スクリーニングから得られた細胞のゲノムDNAからのNGSライブラリーの作成、Illuminaシークエンス(500x以上のカバレッジ)およびデータ解析を含む。 | サンプル当たり65,100円から | 3-5週 |
表2. ライブラリーの複雑性に応じたクローニング価格対応表
| ライブラリーの複雑性 | 価格 (税別、送料別) | 作業日数 | |
|---|---|---|---|
| <106 | 434,000円から | 5-8週 | |
| 106 ~ 107 | 620,000円から | 5-8週 | |
| 107 ~ 108 | 1,007,500円から | 8-11週 | |
| >108 | お問い合わせください | ||
技術情報
バーコード長と複雑性
ヌクレオチドでバーコードをデザインするには、DNA塩基にユニークな配列を割り当て、さまざまな情報を組み入れる必要があります。 始めに、短い塩基配列は特定の細胞の識別子のような基本情報を表現することができます。例えば、"ATCG "は細胞1を表し、"TAGC "は細胞2を表します。バーコードの長さが長くなるにつれて、コード化される情報の複雑さと多様性は指数関数的に増大していきます。バーコード配列が長いほど、より多くの異なる順列が利用可能になり、より多くのバリエーションを一意に識別できるようになります。
バーコードライブラリーの最大複雑度は、与えられたヌクレオチドで生成可能な組み合わせの数に基づいて計算できます。ランダム化されたヌクレオチドからなるバーコードの場合、各位置で4種の塩基が来る可能性があります。: 与えられたバーコードの長さ(N)に対する可能な組み合わせの総数(複雑さ)は4Nです 。例えば、ランダム化されたNNNバーコードは64(43)通りの組み合わせが可能になります。
バーコードベクターの設計
ベクターにバーコードを配置するためには、効果的にシークエンスできること、ライブラリーのクローニング、スクリーニング、デコンボリューション工程との互換性が確保できるように戦略的な考慮が必要です。レンチウイルスベクターの場合、バーコードはgRNAや可変領域などと一緒にウイルスベクターのゲノム挿入領域内に組み込まれ、宿主ゲノムへ挿入されることが必要です。また、mRNA転写領域内にバーコードを配置して、バーコードを読むことでmRNA転写産物を同定することも可能です。解析を容易にするため、バーコード配列はPCRで増幅可能な領域に配置される必要があります。さらに、バーコードのデザインはNGSでも検出できるように検討され、NGSによって正確な検出と定量が保証される必要があります。理想的には、バーコード配列はアーティファクトを避けるため、研究対象の生物学的プロセスに干渉しないことが望ましいが、これには多くの事前知識が必要となります。
バーコードと可変領域の対応を1対1にするか、多対1にするのかも重要な検討事項です。1対1のケースでは、単一のバーコード配列は特定の可変領域に対応しますので、単純かつ直接的な両者の紐づけが可能です。多対1のケースでは、複数のバーコードが同じ可変領域に対応することになります。この状況は大きな利点となり、特定の可変領域に対応する複数バーコードの検出をbiological replicateとして扱うことできるので、検出結果の統計的な信頼性を高めることができます。統計的信頼性の増加によって、ハイスループット実験におけるポジティブなシグナルとランダムな変動の区別とつけやすくなります。さらに、同じ可変領域に複数のバーコードを使用することでクローン解析が可能になります。これは腫瘍細胞のように均一性が低い細胞集団の研究に役立ちます。
バーコード導入とNGSによる読み出し
バーコードを細胞へ導入するためには、レンチウイルス、AAV、レトロウイルスなどのウイルスベクター、またはpiggyBacやSleeping Beautyのようなトランスポゾンベクターを使用します。ベクターシステムの選択は、標的細胞のタイプ、デリバリー効率、希望するバーコード発現期間などを考慮して決定してください。NGS解析用に細胞バーコードを単離する場合、バーコードをRNAから読み出すか、それともゲノムDNAから読み出すのかに応じて適切なベクターシステムを選ぶ必要があります。バーコードを細胞のゲノムDNAに恒久的に組み込むベクターシステムは、ゲノムDNAからの読出しに適しています。バーコードの位置は慎重に検討される必要があり、PCR増幅が可能で、NGSシークエンスができるように設定することが極めて重要です。一方、バーコードをRNAから読み出す場合は、バーコードが転写産物の一部として発現する必要があります。トランスクリプトームとバーコードの両方の情報を同時に取得するシングルセルRNAseq実験(Perturb-Seq、CROP-Seq)では、RNAからのバーコード読出しは実験デザイン上に必須となります。
実験データ
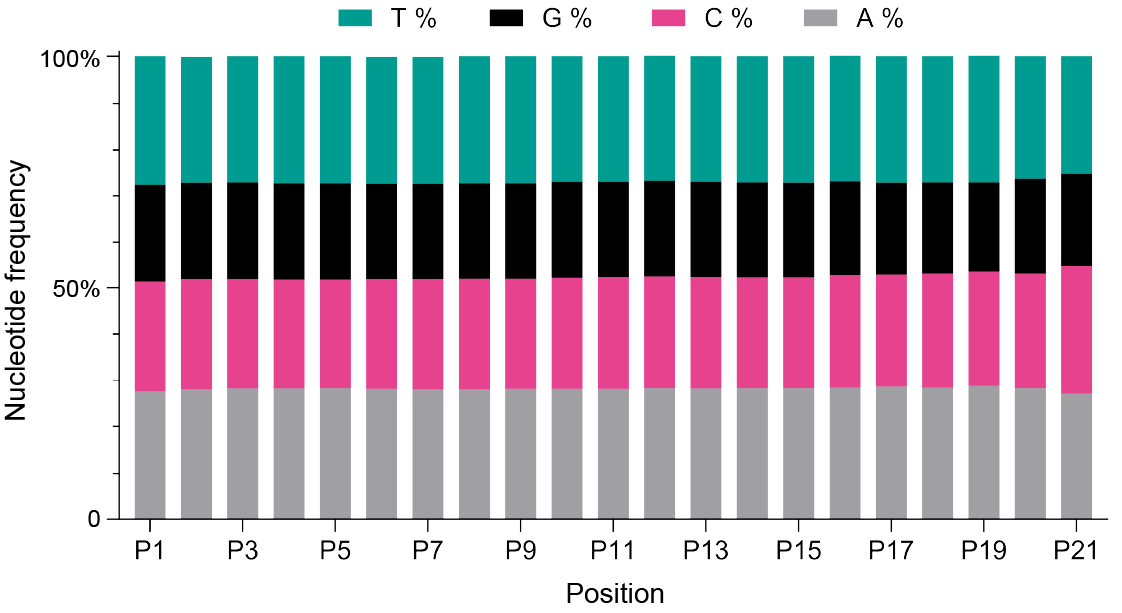
図1. 縮重ヌクレオチド戦略を用いたN(21)バーコードにおけるヌクレオチド分布。各位置におけるアデニン(A)、シトシン(C)、グアニン(G)、チミン(T)の割合を示す。すべての位置でヌクレオチドが均等に分布している。
注文方法
お客様提供のプール型プラスミドライブラリー
お客様によって作製されたライブラリーDNAを使用する場合は、マテリアル提出ガイドラインにしたがってライブラリーDNAを郵送してください。作業遅延やライブラリーのダメージを避けるために、当社のガイドラインに忠実に従った梱包をお願いいたします。お客様から提供されたすべてのマテリアルは、必ずベクタービルダーによる品質検査を受ける必要があり、マテリアル当たり16,000円の検査費用が発生します。マテリアルが品質検査を通過しないとライブラリー構築が開始できないことをご承知おきください。お客様によって作製されたプラスミドライブラリーからライブラリー構築をする場合、当社で最終的なライブラリーの複雑性と均一性の保証はいたしかねます。
リソース
FAQ
ベクターシステム: 標的細胞や実験要件を考慮してレンチウイルス、レトロウイルス、AAVもしくはトランスポゾンシステムなど、適切なシステムを選択する。ベクターシステムによっては、細胞ゲノムへのバーコードの挿入と安定性に影響を与える。
バーコード長: 最適なバーコード長を決定することは極めて重要。スクリーニングスケールとバーコードライブラリーの理論上の最大複雑度を考慮する。長いバーコードはより高い複雑性を可能にするけれども、配列合成と読み出しに課題がある。
1対1または複数対1の対応: 各バーコードが単一の可変領域(1対1の相関)に対応するか、複数のバーコードが単一の可変領域を表すかを決定する。ライブラリーから得られる情報の分解能、特異性、統計的な信頼性に影響を及ぼす。
バーコード配列の設計: 既存デザイン配列またはランダムなバーコード構造(固定またはランダム)を含めるなどのバーコード配列のデザイン戦略。配列設計はバーコード合成とライブラリー構築のおける全体的なクローニング戦略に影響する。
バーコードの位置: バーコードをゲノムもしくはRNAから読むなどの状況に応じて、バーコードの配置を慎重に検討する。クローニング可能であることを担保することや、NGSによって安定して読むことが出来ることを確認する。
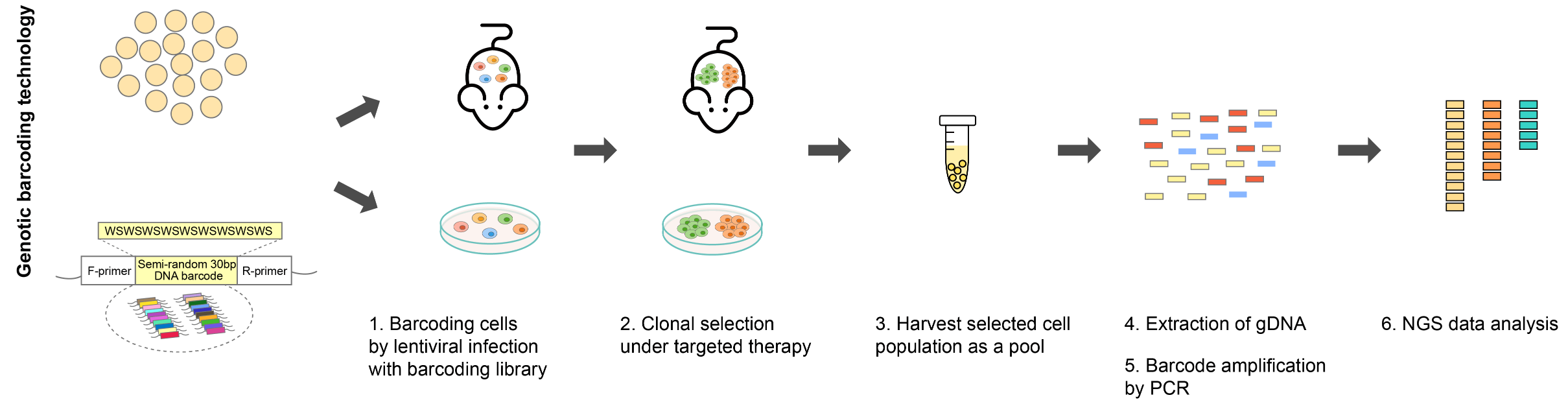
図2. バーコード実験のワークフロー例
ウイルスベクターによるバーコード導入では、各細胞をユニークなバーコードで標識するために、バーコードライブラリーを低い感染多重度(MOI)で細胞にトランスダクションする。クローン集団が出現するまで、バーコード化された細胞集団を選択圧にさらす。プールされた抵抗性クローンからゲノムDNAまたはRNAが抽出され、バーコード配列がPCR増幅されたのちにNGSによってバーコードを読み出す。NGSデータから集団内のクローン数と各クローンの相対的存在量を定量できる。




