GMPウイルスベクター製造

VectorBuilderは、様々な種類のウイルスの作成に関する広範な専門知識と経験を持っています。当社は、遺伝子治療薬開発パイプラインに沿った、あらゆる要求に応えるため、様々な規模と品質のウイルス製品を提供します。アデノ随伴ウイルス (AAV) とレンチウイルスの大規模GMP製造のためのプラットフォーム技術を確立し検証しています。またアデノウイルス、 MMLV、単純ヘルペスウイルス (HSV)、そして水泡性口炎ウイルス (VSV)など、他の種類のウイルスベクターの製造経験も豊富にあります。創薬研究、臨床研究、臨床試験、商品化など様々なダウンストリームのアプリケーションをカバーした、異なるグレードのウイルスをご提供します。
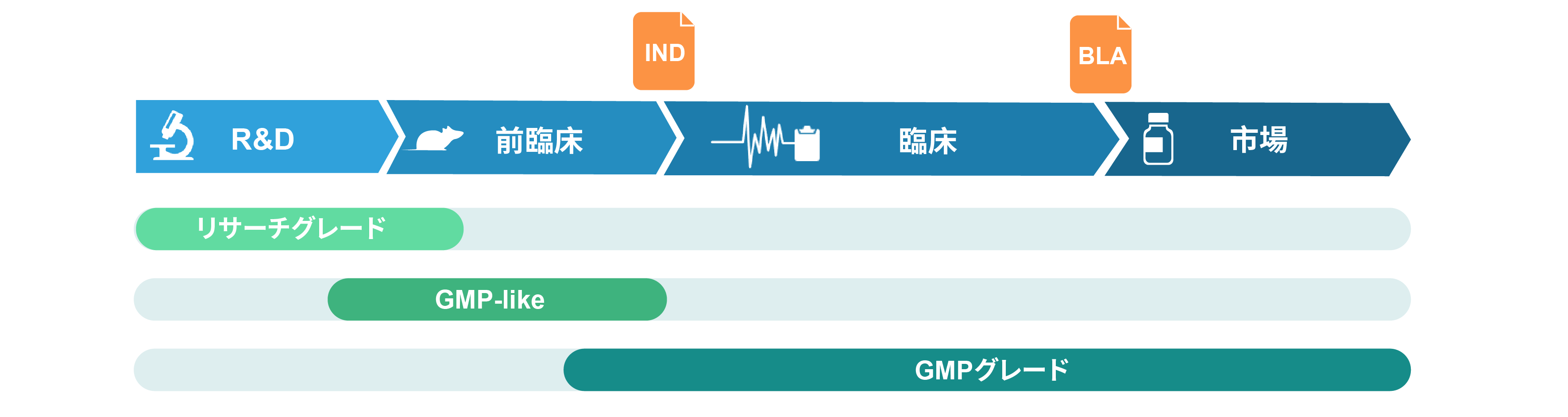
提供しているウイルスベクターのグレード
-
リサーチグレードウイルス
リサーチグレードウイルスは、基礎研究や創薬研究を目的としています。製造は従来の細胞培養施設で行います。ウイルスの品質が、要求基準を満たすことを保証するために、厳格なQCアッセイを実施しています。
リサーチグレードウイルス製造サービスを読む -
GMP-likeウイルス
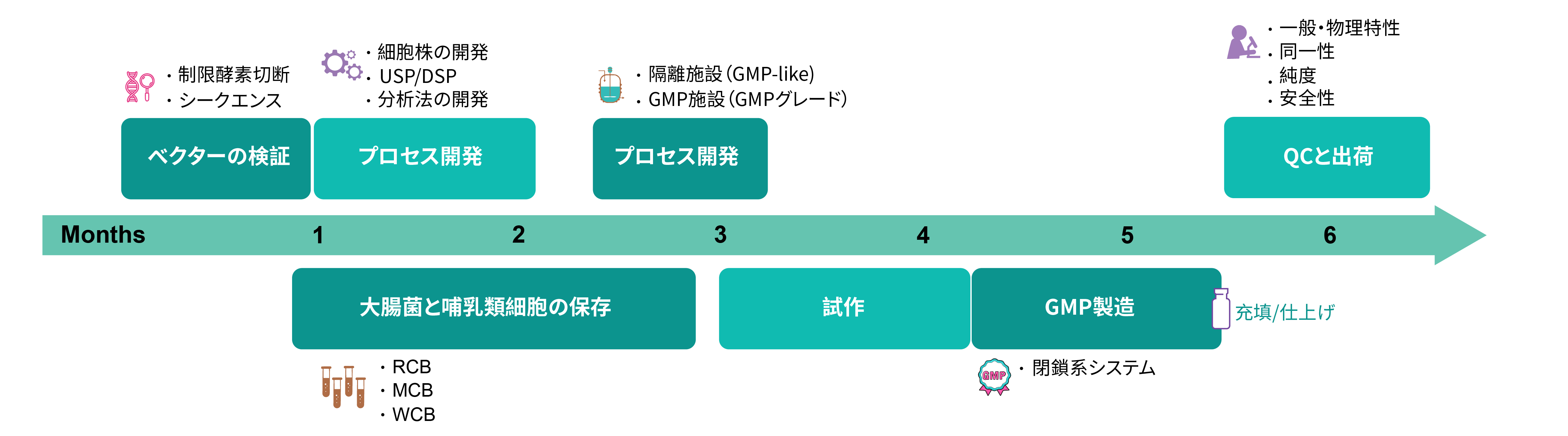
GMP-likeウイルスは、薬物の安全性と代謝研究のための動物実験などの前臨床研究を目的使用を目的としています。これはGMPガイドラインのうち主要な項目を満たす条件で製造され、GMPと同等の製造プロセスで製造され、同等の品質を満たすウイルスとなっています。ウイルスの製造は、ドキュメント管理と、トレーサビリティーを備えた、隔離製造スイートで行われます。したがって GMP-likeグレードでは最終的なGMP製品をスモールスケールで模倣しているとみなせます。GMP-likeグレードの特長は、GMPに比べてコストがはるかに低く、タイムラインも短縮されます。品質検査証明書(certificate of analysis :COA) が、製品のリリース時に発行されます。ご依頼に応じてTSE/BSE証明書も発行します。
-
GMPウイルス
GMPグレードのウイルスは厳格なGMPガイドラインに従って、認定されたGMP細胞培養スイートで生産されます。一連のインプロセス(in-process)およびリリースQCアッセイを含む包括的な品質管理保証システムが製造プロセスを通じて組み込まれています。ウイルスが品質と安全性に関して、仕様と規制基準を確実に満たすようにしています。製品リリース時には、品質検査証明書(Certificate of analysis: COA)と、製造プロセスを漏らすことなくドキュメント化したバッチリリース報告書が発行されます。
ウイルスグレードの比較
| リサーチグレード | GMP-like | GMPグレード | |
|---|---|---|---|
| アプリケーション | 基礎研究, 治療薬開発, および 前臨床研究 | 薬物の安全性や代謝に関する動物を使った前臨床試験、GLP試験 | 前臨床試験, 臨床試験, および商用 |
| 製造スケール | バッチごとに 5x1010 to 1014 GC | バッチごとに5x1013 to 1017 GC | バッチごとに1014 to 1017 GC |
| 作業日数 | 10-50 日 | 4-5 カ月 | 6 カ月-1 年 |
| 製造場所 | 標準的なBSL-2実験室での並行生産 | 隔離されたBSL-2製造スイートで製造 | 認証されたGMPスイート(BSL-2)で製造 |
| 品質管理システム | ISO9001 | GMP製造の主要な特長を取り入れた ISO9001 | GMP製造のためのICH品質ガイドライン |
| 文書管理とトレーサビリティ | なし | あり | 全ての工程においてあり |
| ベクターの性能管理 | 制限酵素処理, ITR間シークエンシング | シークエンシング | シークエンシング |
| プロセス開発 | なし | 個々のプロジェクトのニーズに合わせて実施 | あり |
| 細胞バンク | なし | 要望があれば可能 | あり |
| 抗生物質フリー | なし | 要望があれば可能 | あり |
| 動物由来成分フリー | なし | 要望があれば浮遊培養系で実施可能 | 浮遊培養系に関して実施可能 |
| 精製 | 超遠心法 | 超遠心法、アフィニティー精製、IEX精製、混合クロマトグラフィー | 超遠心法、アフィニティー精製、IEX精製、混合クロマトグラフィー |
| QCおよび出荷時検査 | タイター測定, SDS-PAGE, エンドトキシン測定, 無菌テスト, マイコプラズマ測定, 等 | 個々のプロジェクトのニーズに合わせて実施 | 全てのQCアッセイを実施、および 個々のプロジェクトのニーズに合わせた解析 |
| 無菌充填 | なし | 要望があれば可能 | あり |
| サンプルの保存 | 要望があれば可能 | 要望があれば可能 | あり |
| 交付書類 | COA | 1. COA 2. 製造サマリー 3. TSE/BSE 文書(要望があった場合のみ) |
1. COA 2. TSE/BSE 文書 3. CTD文書 (CommonTechnicalDocument) 4. BMR 等、 その他リクエストに応じて対応 |
| リサーチグレード | GMP-like | GMPグレード | |
|---|---|---|---|
| アプリケーション | 基礎研究, 治療薬開発, および 前臨床研究 | 薬物の安全性や代謝に関する動物を使った前臨床試験、GLP試験 | 前臨床試験, 臨床試験, および商用 |
| 製造スケール | >2.5x107 TU | バッチごとに109 to 1012 TU | バッチごとに5x109 to 1012 TU |
| 作業日数 | 8-16 日 | 4-5 カ月 | 6 カ月-1 年 |
| 製造場所 | 標準的なBSL-2実験室での並行生産 | 隔離されたBSL-2製造スイートで製造 | 認証されたGMPスイート(BSL-2)で製造 |
| 品質管理システム | ISO9001 | GMP製造の主要な特長を取り入れた ISO9001 | GMP製造のためのICH品質ガイドライン |
| 文書管理とトレーサビリティ | なし | あり | 全ての工程においてあり |
| ベクターの性能管理 | なし | シークエンシング | シークエンシング |
| プロセス開発 | なし | 個々のプロジェクトのニーズに合わせて実施 | あり |
| 細胞バンク | なし | 要望があれば可能 | あり |
| 抗生物質フリー | なし | 要望があれば可能 | あり |
| 動物由来成分フリー | なし | 要望があれば浮遊培養系で実施可能 | 浮遊培養系に関して実施可能 |
| 精製 | 超遠心法 | 超遠心法、アフィニティー精製、IEX精製、混合クロマトグラフィー | 超遠心法、アフィニティー精製、IEX精製、混合クロマトグラフィー |
| QCおよび出荷時検査 | タイター測定, 無菌テスト, マイコプラズマ測定, 等 | 個々のプロジェクトのニーズに合わせて実施 | 全てのQCアッセイを実施、および 個々のプロジェクトのニーズに合わせた解析 |
| 無菌充填 | なし | 要望があれば可能 | あり |
| サンプルの保存 | 要望があれば可能 | 要望があれば可能 | あり |
| 交付書類 | COA | 1. COA 2. 製造サマリー 3. TSE/BSE 文書(要望があった場合のみ) |
1. COA 2. TSE/BSE 文書 3. CTD文書 (CommonTechnicalDocument) 4. BMR 等、 その他リクエストに応じて対応 |
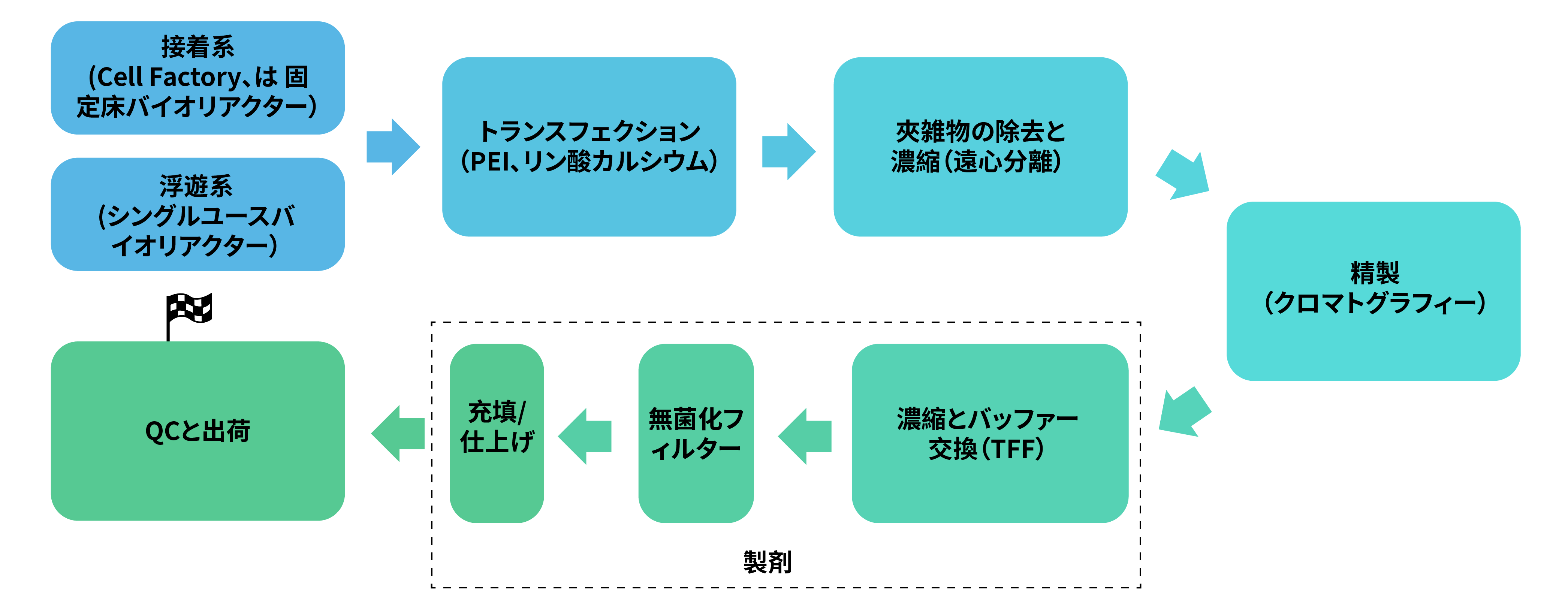
GMP-likeとGMPウイルス製造のワークフロー
プラットフォームテクノロジー
AAVパッケージングはHEK293細胞を使用し、培養条件は接着培養(Cell Factory または 固定床バイオリアクター/fixed-bed bioreactors) または無血清浮遊培養 (200L までのシングルユーズのバイオリアクターを使用)に対応しています。 昆虫由来のSf9細胞を使用したAAVパッケージングにも対応しています。バッチ当たりの最大スケールは1017 GCです。
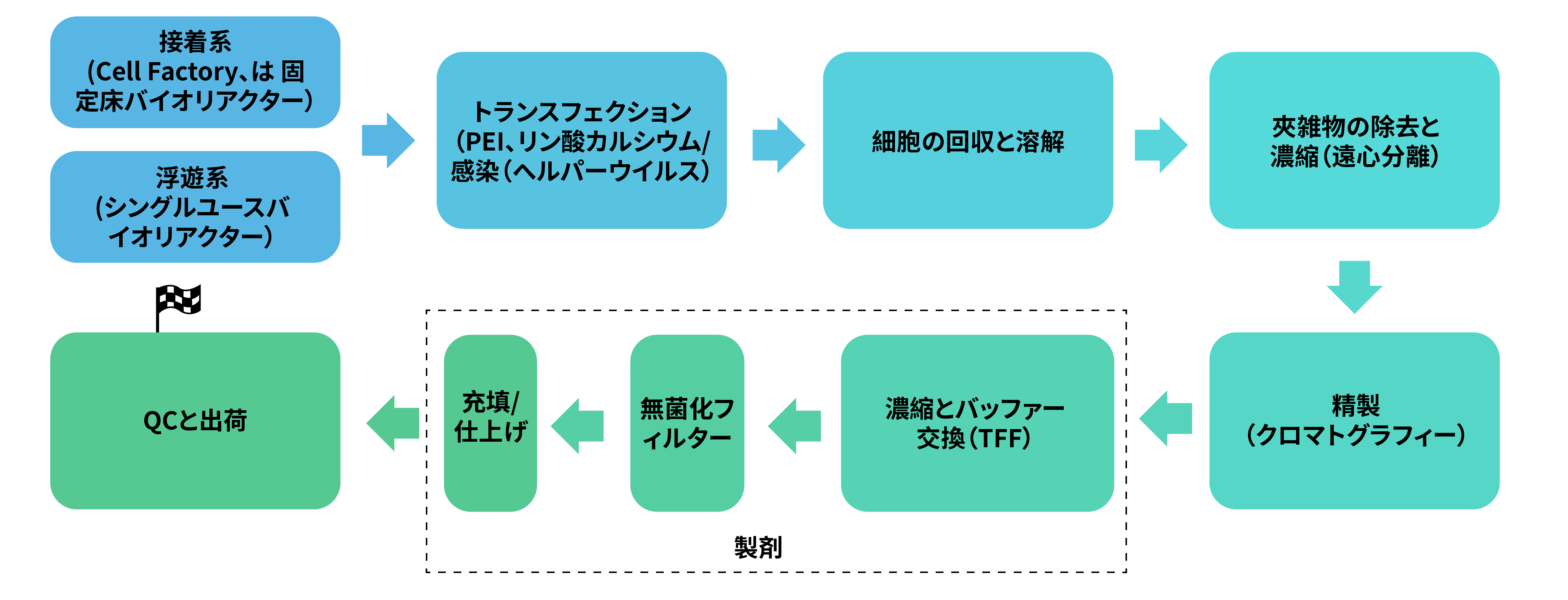
レンチウイルス(第二世代、第三世代、VSV-Gシュードタイプ、または他のウイルス表面タンパク質のシュードタイプ化)に対応しています。ウイルス産生細胞は HEK293で、培養条件は、接着培養(Cell Factory または 固定床バイオリアクター/fixed-bed bioreactors) または無血清浮遊培養 (200 L までのシングルユーズのバイオリアクターを使用)に対応しています。バッチ当たりの最大スケールは 1012 TU です。