IVT mRNA
流行の遺伝子医療となっているin vitro transcription mRNA(IVT mRNA)には、挿入変異原性のリスクがないこと、合理化された無細胞系製造システム、パーソナライズされた治療法の開発など、いくつかの利点があります。IVT mRNAは、ワクチン、タンパク質置換、CAR-T、CRISPR遺伝子編集など、幅広い治療用途に応用できます。ベクタービルダーのRNA専門チームは、 カスタムIVT mRNAデザイン、 製造、 LNPカプセル化などについて幅広いカスタマイズをサポートします。
担当者に相談
特長

商業利用のためのIP制限のない、ロイヤリティフリーのmRNA産生用IVTバックボーン

ベクターのクローニングからLNPカプセル化まで5週間ほど

キャッピング法、修飾ヌクレオチド、ポリ(A)テール、UTRを含む包括的なカスタマイズ性

最高の発現、収率、品質を実現するmRNAの最適化に特化した専門設計・製造チーム
サービス詳細
技術情報
下の模式図はmRNAの基本的なコンポーネントを表したもので、各コンポーネントは遺伝子発現の制御において重要な役割を担っています。In vitroでこれらのコンポーネントを組み合わせるためには様々な方法があり、ベクタービルダーは各プロジェクトに最適な発現、収率、純度を達成するための最適な方法を評価するサポートをしています。 ベクターアカデミー の記事 mRNA医薬の基礎 にも、治療用 mRNAについて説明があります。
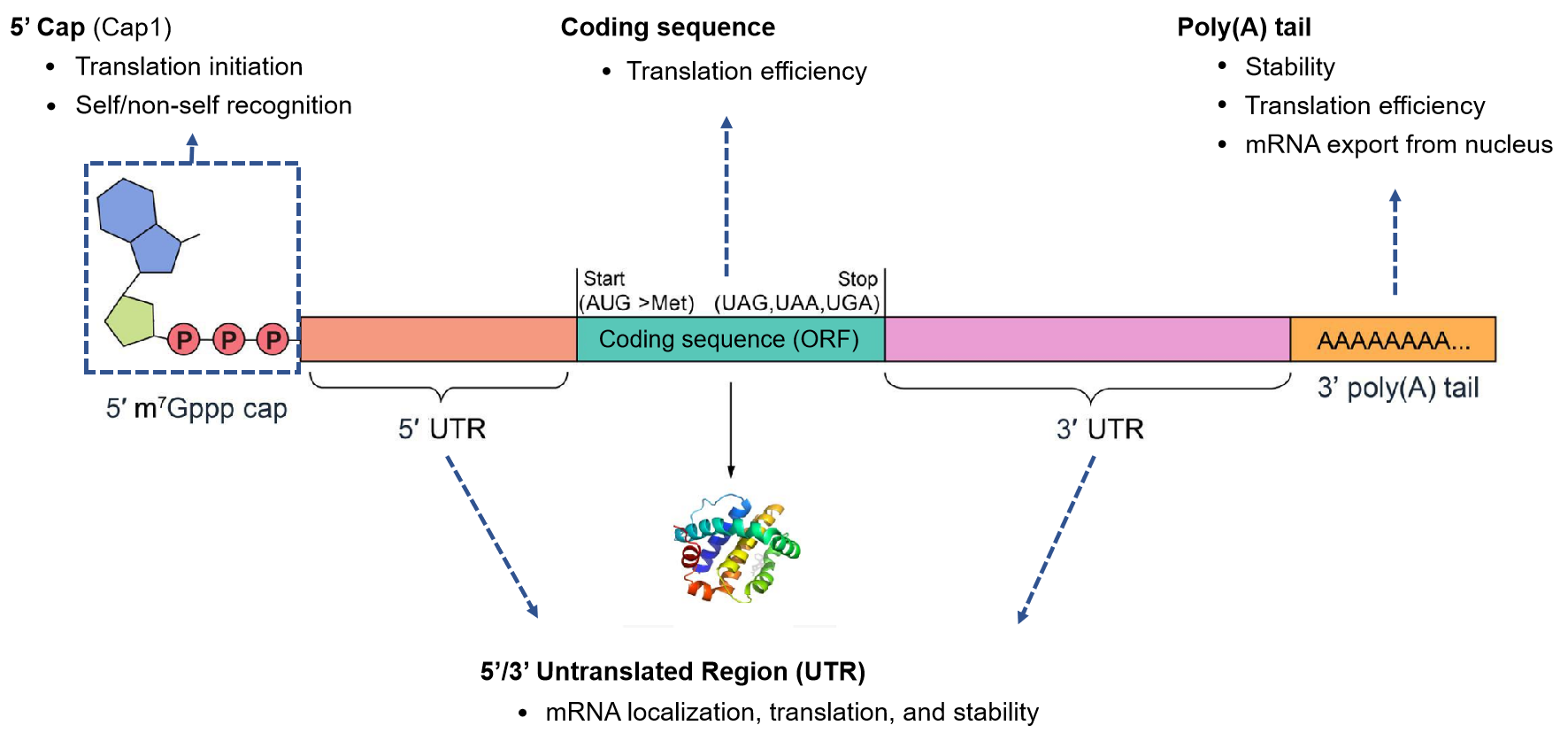
図1. mRNAコンポーネントの構造と機能。
- mRNAワクチン開発
- CRISPR遺伝子編集
- CAR-T
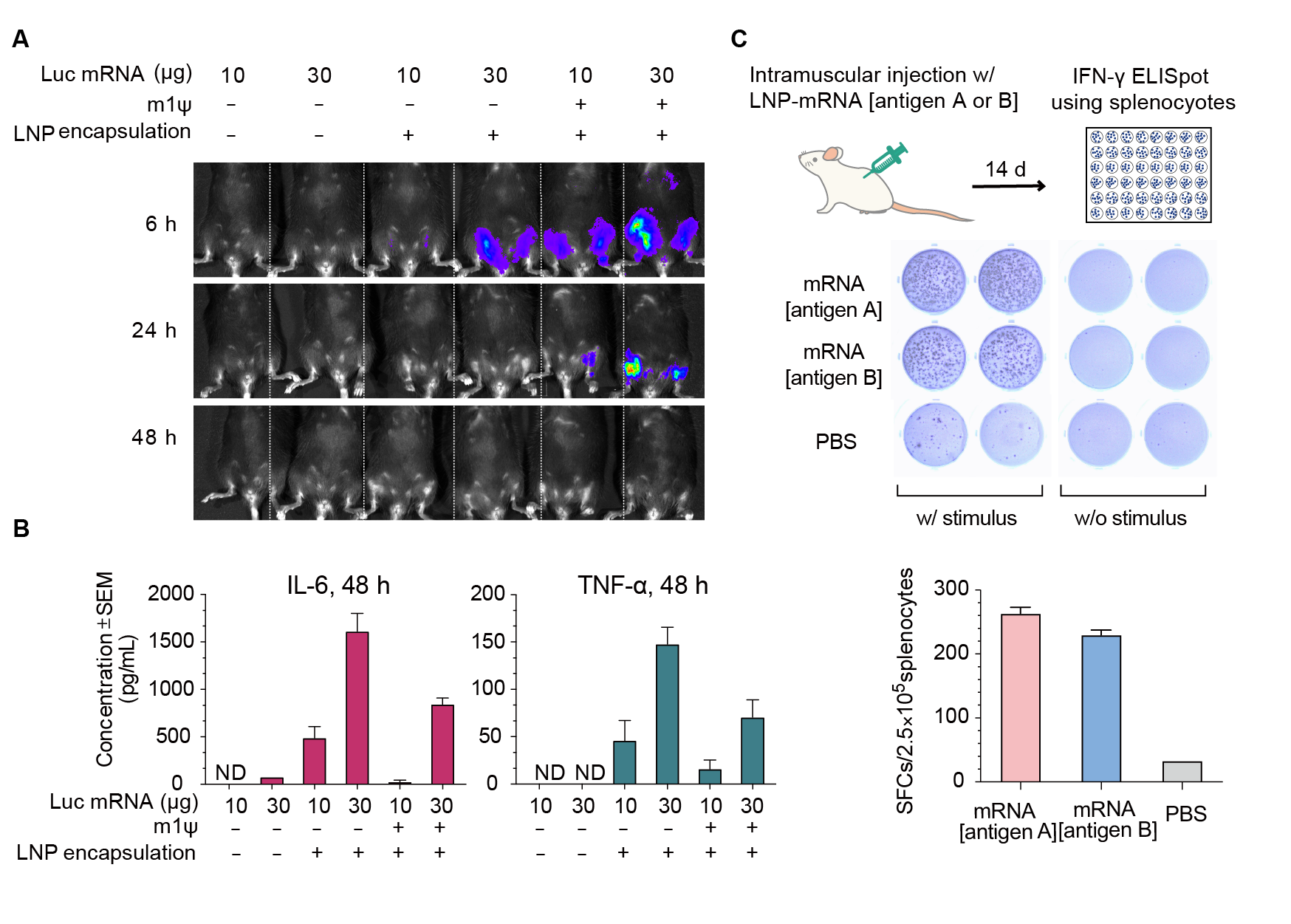
図2. マウスにおけるルシフェラーゼ(Luc)mRNAの発現とmRNAによる免疫応答。(A) インジェクション後6時間、24時間、48時間のライブイメージングによりルシフェラーゼ活性を可視化した。(B)2つの炎症性サイトカイン(IL-6とTNF-⍺)をインジェクション後48時間の血清中で定量した。エラーバーは標準誤差を表す。マウスの系統: C57BL/6J;マウス年齢:8週;注射方法:筋肉内注射。(C)ウイルス抗原A、ウイルス抗原B、またはコントロールPBSをコードする30ugのLNPカプセル化mRNAの筋肉内注射14日後のBalb/Cマウス由来の脾臓細胞のIFN-γ ELISpotアッセイ。
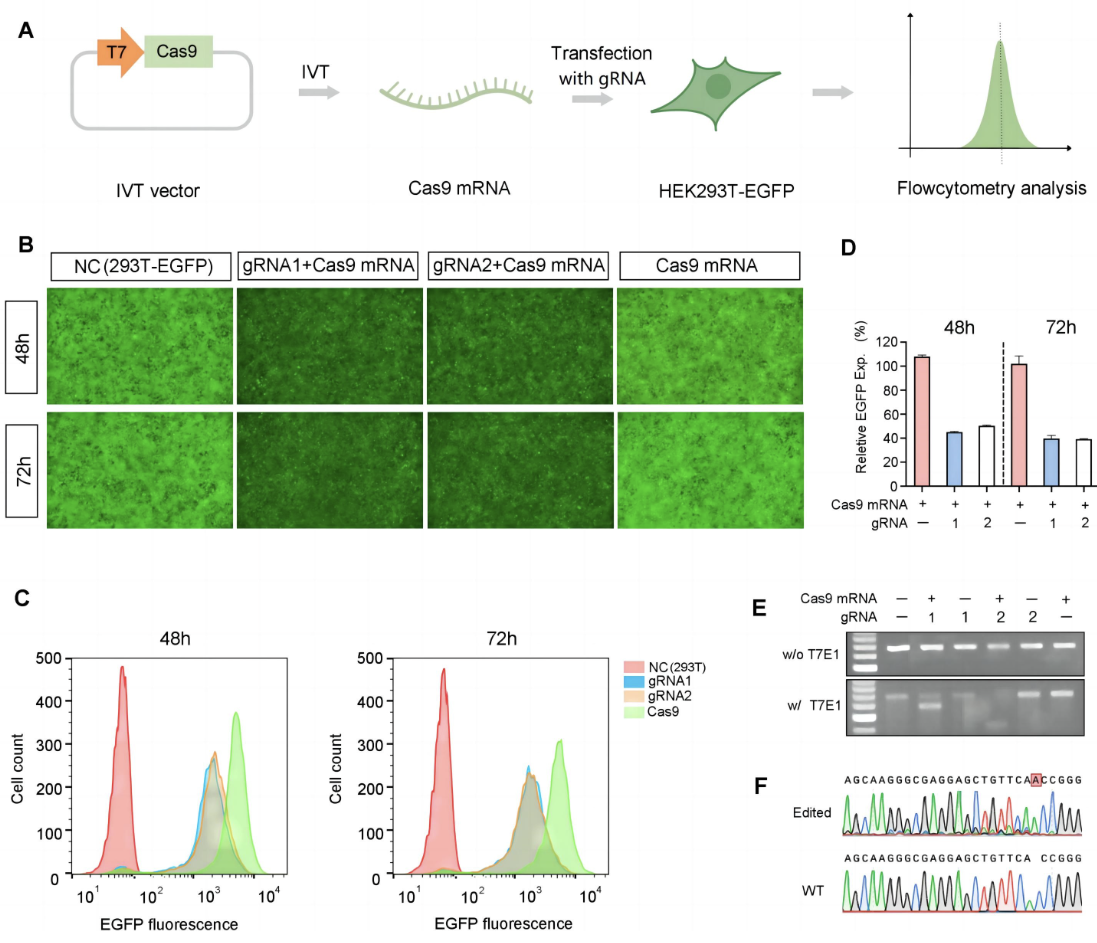
図3. in vitroにおけるhSpCas9 mRNAの検証。 A) IVT Cas9 mRNAを、EGFPを標的とする2種類のgRNAとともに293T-EGFP細胞にトランスフェクションした。非処理(NC)細胞およびトランスフェクション細胞におけるEGFP発現を顕微鏡で観察し(B)、フローサイトメトリーを用いて定量した(C、D)。(E、F)ゲノム上のEGFP遺伝子への編集は、T7E1アッセイとサンガーシークエンスによって確認された。
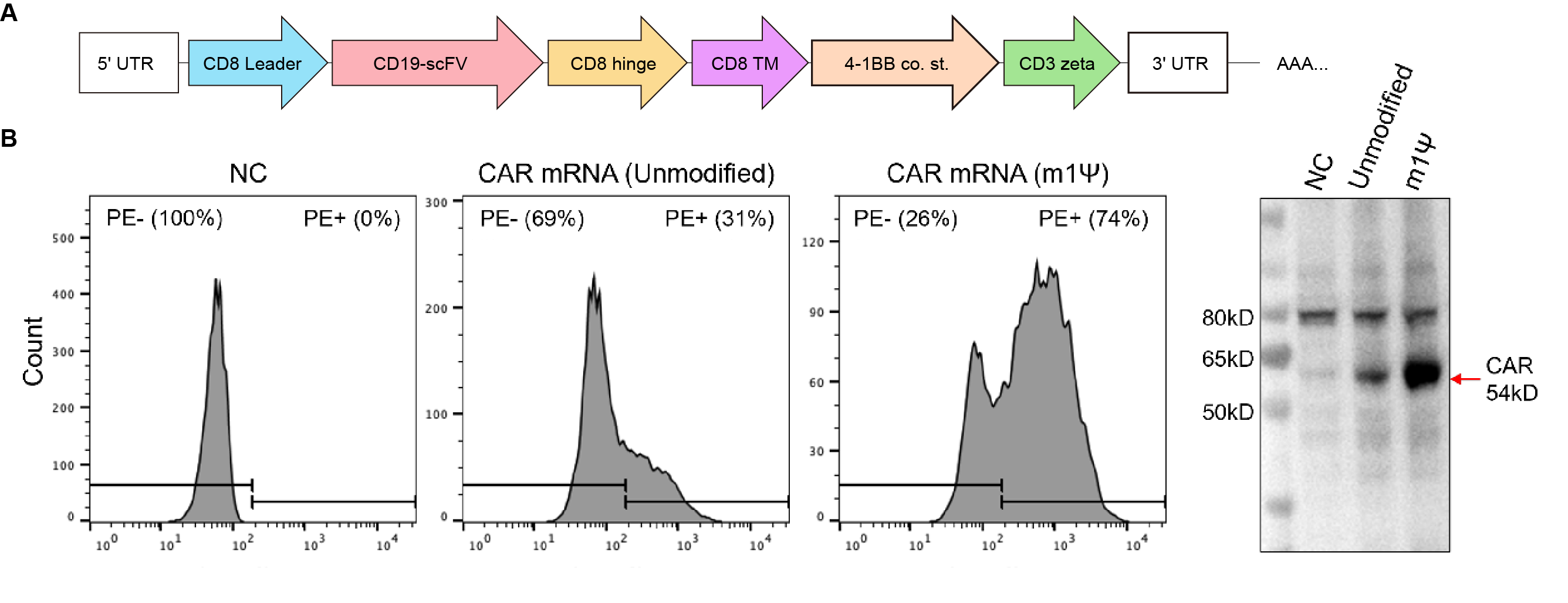
図4. 293T細胞におけるIVTキメラ抗原受容体(CAR)mRNA発現の検証。(A)N1-Methylpseudouridine(m1Ψ)の有り・無しの5'/3'UTRとポリ(A)を持つCD19 CAR mRNAを作製し、293T細胞にトランスフェクションした。(B)トランスフェクション後24時間、細胞をPE標識ヒト抗CD19抗体とインキュベートし、FACSを用いてCAR発現を定量した。(C)発現は、抗CD3zeta抗体とウェスタンブロットを用いて追加検証した。
FAQ
| mRNA | circRNA | saRNA | |
|---|---|---|---|
| 構造 | 直鎖状; 通常は5’ cap, 5’ UTR, ORF for GOI, 3’ UTRとポリAテールを含む | 環状; 通常はIRESとGOIのORFを含む | 直鎖状; 通常は 5’ UTRレプリカーゼとGOIのORF,3’ UTRとポリAテールを含む |
| Cap | 安定性とリボソームのリクルートには 5' Capが必要 | Capなし; リボソームの誘導はIRESに依存 | 安定性とリボソームのリクルートには 5’ Capが必要 |
| RNAの長さ (nt) | 100 ~ 10,000 | 1000 ~ 5000 | 7000 ~ 10,000 |
| 安定性 | 低い | 高い | 低い |
| 修飾ヌクレオチドを取り込ませることが可能か? | Yes | No | Yes |
| 発現量 | 低い | 中程度 | 高い |
| 発現期間 | 短い | 中程度 | 長い |
| 免疫原性 | 低い | 中程度 | 高い |
キャップ0はN7-methylguanosine (m7G)を意味し、5‘-三リン酸結合を介して真核生物mRNAの5’末端側に付加されます。この修飾は一連の酵素反応を経て転写反応と同時に起こり、真核生物翻訳開始因子(eIF4E)に認識されることによってmRNAの核輸送、転写産物の安定化、翻訳反応の増進に機能します。キャップ1はmRNAへのm7G(キャップ0)付加に続いて、最初のヌクレオチド(m7GpppNm)上の2’Oへのメチル基の付加を意味します。哺乳類では、キャップ1の構造はmRNAが自己のものとして自然免疫を回避するためのマーカーとして重要となります。キャップ1を合成mRNAに付加することで、mRNAのin vivoでの翻訳効率の上昇と免疫原性を低下させることができます。
In vitro転写mRNAのキャップはキャップアナログを使用して転写反応中に付加するか、転写反応後の酵素反応によって付加する方法があります。弊社はどちらの方法にも対応しており、キャッピング効率はLC-MS使用して詳細に検査されます。お客様の希望するキャップ方法に依存して、それぞれに対応したIVT mRNAベクターバックボーンへのクローニングを提案しています。
細胞は細胞質とエンドソームにRNA受容体をもち、外来性RNAを検出して免疫反応を引き起こします。修飾ヌクレオチドは内在性RNAに共通して存在しています。特定の修飾ヌクレオチドをIVT mRNAへ取り込ませることで免疫原性の低下、二次構造の変更、翻訳効率の増加、配列依存性の半減期を伸ばすことができます。弊社ではN1-Methylpseudouridine (m1Ψ)や5-Methylcytosine (m5C)を含む、様々な修飾ヌクレオチドを用意しております。N1-Methylpseudouridineや5-Methylcytosineは自然界に存在するヌクレオチドであり、初めにtRNAで見つかりましたが、タンパク質をコードするmRNAにおける機能は近年になって評価されるようになりました。これらのウリジンやシトシンのメチル化派生物は古典的なワトソンークリック塩基対形成に影響を与えることがないので、mRNA in vitro合成および翻訳反応において従来のヌクレオチドを置き換えることができます。このように、mRNA医薬はRNA免疫受容体による認識を回避して免疫反応を低減させ、mRNAの安定性と翻訳効率を高めることができる大きなアドバンテージを持っています。