エンハンサー/プロモーターライブラリー構築サービス
エンハンサーとプロモーターは、遺伝子発現の空間的および時間的パターンを制御するために重要な役割を果たすゲノム上の非コード領域です。エンハンサー/プロモーターのシス制御エレメントを同定し、その遺伝子制御活性を解析し、新規の制御バリアントを工学的エンジニアリングすることは、遺伝子発現を理解し最適化するために不可欠であり、遺伝子治療において大きな意味を持ちます。ベクタービルダーは、in vitroおよびin vivoの両方で大規模な並列スクリーニングを行い、機能的エンハンサー/プロモーターを効率的に同定するための包括的なソリューションを研究者や医薬品開発者に提供しています。
ご相談はデザインサポートを依頼する から
特長
- 合理化されたフルサービスプラットフォーム: ライブラリーとスクリーニング設計、ライブラリー構築、 ウイルスパッケージング、in vitro / in vivoスクリーニング、NGS解析、ヒット同定、機能特性解析を含む包括的なソリューションを提供します。
- ライブラリーデザインの専門家: 高S/N比、バーコードの組み込み、NGSリードアウト戦略など、強力で偏りのない様々なスクリーニングを実現します。
- 高い複雑性をもつライブラリーを高力価、高純度にウイルスパッケージング: 非ウイルス性、レンチウイルス性、AAV、piggyBacおよびその他のデリバリーシステムで高い複雑性>108)のライブラリーを入手可能。ウイルスパッケージサービスには、レンチウイルス(>108 TU/ml)およびAAV(>1013 GC/ml)などが含まれます。
- 非ヒト霊長類(NHP)を含む複数のin vivoモデル:スクリーニングに使用可能なモデルには、マウス、ラット、霊長類以外の2種:カニクイザル(Macaca fascicularis)およびアカゲザル(Macaca mulatta)が含まれる。すべての動物実験はAAALAC認定の施設で遂行されます。
サービス詳細
以下が、エンハンサー/プロモータースクリーニングの典型的なワークフローです:
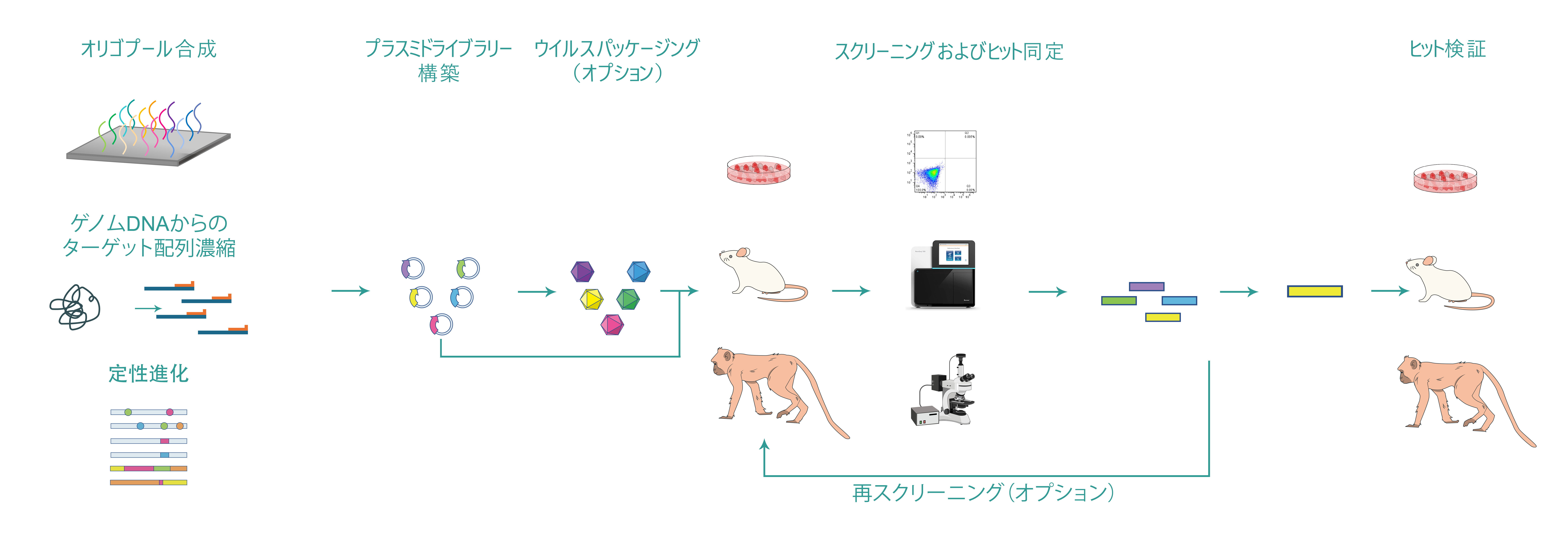
エンハンサー/プロモーターライブラリーの設計と構築
In vitro/in vivoスクリーニング
ヒットの検証
ライブラリーデザイン
以下の図は、エンハンサーライブラリー(図1)とプロモーターライブラリー(図2)の典型的なベクターデザインとなります。

図1. エンハンサーライブラリーの主要ベクターコンポーネント。
エンハンサー:スクリーニング対象となるエンハンサー配列は、レポーター遺伝子の上流にも下流にも挿入できる。エンハンサーがレポーター遺伝子の下流(A)に位置し、ポリ(A)シグナルの前にある場合、レポーター遺伝子と一緒に転写されるため、mRNA-seqで直接観察可能。レポーター遺伝子の上流(B)に位置する場合、一般的にバーコード配列がレポーター遺伝子の3'UTR領域に組み込まれ、レポーター遺伝子と一緒に転写される。バーコードはエンハンサーの代わりとしてmRNA-seqで配列決定される。
最小プロモーター:ユーザーが選択した最小プロモーター配列がここに置かれる。転写を活性化するエンハンサーエレメントが存在すれば、下流レポーターの転写を促進することが可能。エンハンサーがない場合、最小プロモーターはほぼ不活性。
一般的に使用されている最小プロモーターの詳細については、こちらをクリックしてください
Kozak:Kozakコンセンサス配列。真核生物では翻訳開始を促進すると考えられているため、目的のORFの開始コドンの前に配置される。
レポーター:視覚的に検出可能な蛍光タンパク質遺伝子(GFPなど)または化学発光タンパク質遺伝子(ルシフェラーゼなど)。エンハンサー活性の高感度検出が可能。
バーコード: エンハンサーライブラリーにおけるバーコードは、個々のプラスミドがもつユニークな短い配列である。スクリーニング後、NGS解析により各バーコードのリードカウントが決定される。ユニークなバーコード配列と特定のエンハンサーバリアントを相関させることにより、特定のエンハンサーの転写活性を同定することができる。
SV40 late pA: シミアンウイルス40後期ポリアデニル化シグナル。上流ORFの転写反応を終了させる。
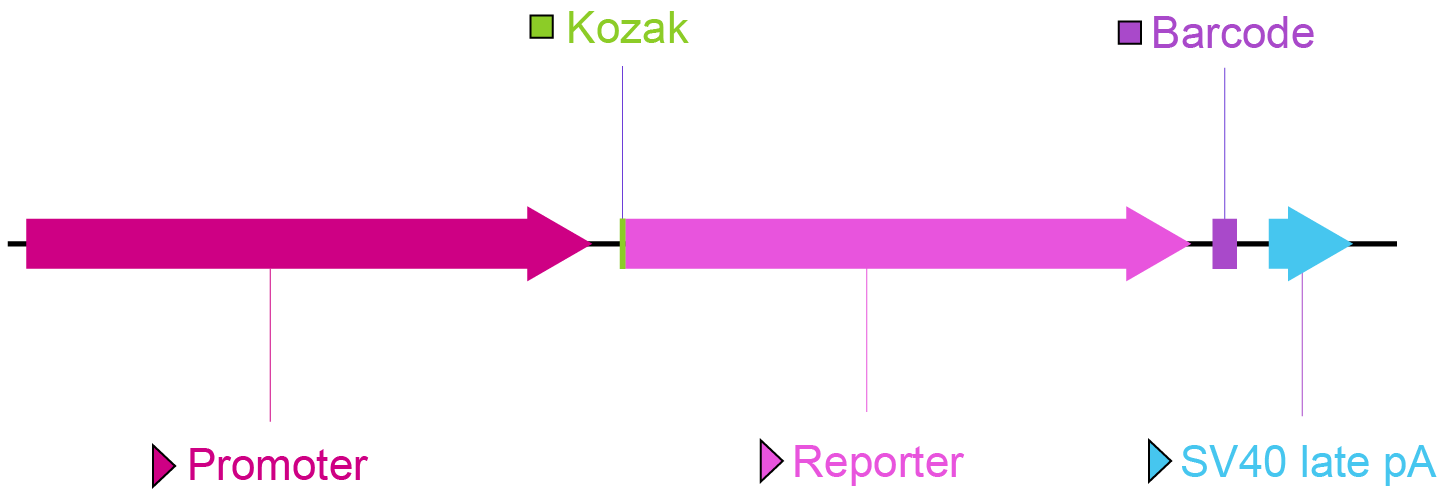
図2. プロモーターライブラリーの主要ベクターコンポーネント。
プロモーター:スクリーニングするプロモーター配列を配置され、レポーターを発現する。
Kozak: Kozakコンセンサス配列。真核生物では翻訳開始を促進すると考えられているため、目的のORFの開始コドンの前に配置される。
レポーター:視覚的に検出可能な蛍光タンパク質遺伝子(GFPなど)または化学発光タンパク質遺伝子(ルシフェラーゼなど)。エンハンサー活性の高感度検出が可能。
バーコード: プロモーターライブラリーにおけるバーコードは、個々のプラスミドがもつユニークな短い配列である。スクリーニング後、NGS解析により各バーコードのリードカウントが決定される。ユニークなバーコード配列と特定のプロモーターバリアントを相関させることにより、プロモーターの転写活性を同定することができる。
SV40 late pA: シミアンウイルス40後期ポリアデニル化シグナル。上流ORFの転写反応を終了させる。
最適なライブラリーデザインはスクリーニング成功の鍵である。エンハンサー/プロモーターライブラリーをデザインするために考慮するべき重要な事柄:
- デリバリーシステム
非ウイルス性プラスミド、レンチウイルス、トランスポゾン はin vitroスクリーニングに広く用いられる一方、AAVはしばしばin vivoスクリーニングに用いられます。ウイルスのタイターやセロタイプが投与経路や組織向性に合致していることが極めて重要です。また、ライブラリーの複雑性が高く、かつ機能的バリアントの割合が比較的低い場合、細胞内のプラスミドのコピー数が多くすることで、シグナルの読み出しが効果的にできるため、ウイルスやトランスポゾン系よりも非ウイルス性プラスミドによるトランスフェクションが好まれます。ベクターシステムの比較に関する詳細は、FAQをご覧ください。
- バーコード
ユニークなバーコードが必要かどうかは、主にライブラリーのタイプに依存します。エンハンサー/プロモーターがレポーター遺伝子の上流に配置されている場合(図1Bと2)、バーコードはレポーター遺伝子の下流、3'UTRの前に配置されます。スクリーニング後、mRNAを抽出して、NGSによってエンハンサー/プロモーター活性のプロキシとして機能するバーコードを読み取り、対応するエンハンサー/プロモーターの転写活性を評価できます。逆に、エンハンサーがレポーター遺伝子の下流に位置している場合(図1A)、NGSによって転写活性を直接測定できます。しかし、エンハンサーが長い場合は、正確な読み出しを保証するためにバーコードが必要な場合があります。バーコードの詳細については、バーコードライブラリー構築ページをご覧ください。
- スケーラビリティ
セルソーティングを行うことで、機能的エンハンサー/プロモーターの検出感度が高めることができ、スクリーニングのスケーラビリティと効率が向上します。セルソーティングは、既知の細胞マーカーもしくはライブラリーベクターからのレポーター遺伝子の発現を検出することによって達成できます。
ライブラリー構築
スクリーニングに用いるエンハンサー/プロモーター配列は、以下の一般的なアプローチによって作製します:
- DNAチップによるオリゴ合成
チップベースのオリゴ合成は、あらかじめデザインされた短いエンハンサー/プロモーターバリアントプールを作製するのに理想的です。この方法では、300ヌクレオチド長までのオリゴプールを低エラー率で合成できます。
- ゲノムDNAからの標的配列の濃縮
標的ゲノム領域の断片は、断片化およびサイズ分画されたゲノムDNAまたはbacterial artificial chromosome(BAC)からプローブハイブリダイゼーションによって集めることができます。または、ゲノムDNAまたはBACに偏りが生じないようにショットガン法を使用することも可能です。
- 定性進化
error-prone PCR、縮重コドンの使用、DNAシャッフリングなどの様々な変異誘発戦略を用いて、既知のエンハンサー/プロモーターから新しい配列バリアントを作製できます。
In vitro / in vivoスクリーニング
エンハンサー/プロモータースクリーニングは、in vitroとin vivoのどちらでも実行可能です。in vitroスクリーニングは一般的に簡便で短期間で完了できますが、in vivoでの生理的条件を再現することはできません。In vivo動物モデルは、転写活性を向上させたエンハンサーやプロモーターをスクリーニングするための信頼できるプラットフォームとなります。エンハンサー/プロモーターライブラリーのin vivoスクリーニングには、マウスと非ヒト霊長類(NHP)の両方が利用されますが、ヒトとの高い類似性のためにNHPモデルは、遺伝子治療への応用において極めて重要な要素であり、より臨床に近い条件で目的とする特性を持つ制御エレメントを同定するためのプラットフォームを提供します。
in vivoスクリーニングでは、尾静脈注射、顔面静脈注射(新生児マウスおよびラット用)、脳室内注射、髄腔内注射、網膜下注射、硝子体内注射、鼓膜内注射、筋肉内注射など、複数の投与経路が選択可能です。
エンハンサー/プロモーターライブラリーを標的細胞または動物に送達した後、レポーター遺伝子またはバーコードの発現を測定することにより、候補調節エレメントバリアントの活性を評価します。望ましい特性を持つ制御エレメントを同定するために、活性が増強されたバリアントに対して複数回のスクリーニングが追加されます。図3は、錐体特異的プロモーターAAVライブラリーの構築とin vivoスクリーニングの主な手順を示しています。
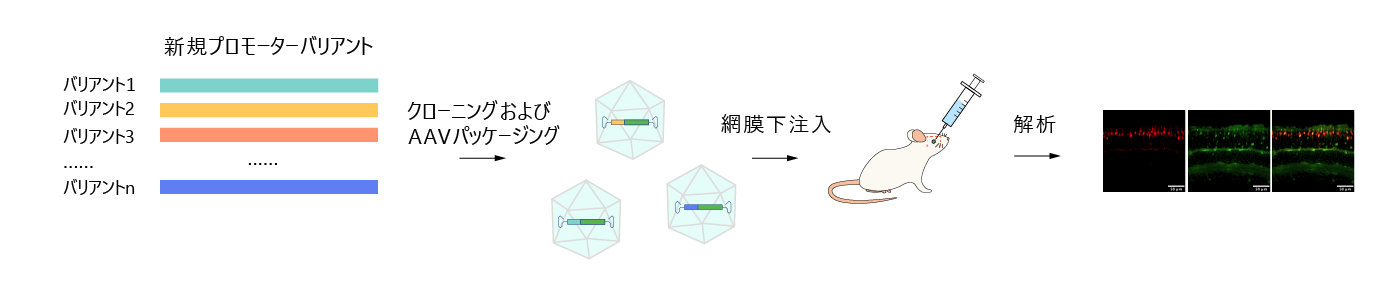
図3. ベクタービルダーが実施した錐体特異的プロモーターAAVライブラリーの構築とスクリーニング。新規プロモーターバリアントを作製、AAVバックボーンにクローニング、レポーター遺伝子の発現を駆動するために使用した。その後、AAVプロモーターライブラリーをマウスの網膜下領域に注入し、包括的なスクリーニングと解析を行った。
ヒットの検証
in vitroとin vivoのどちらでも、エンハンサー/プロモータースクリーニングから同定されたポジティブヒットは、得られた活性について追加の特性評価が必要となります。特性評価には、機能的に最も関連性の高い実験系を使用してください。例えば、図3における錐体特異的プロモータースクリーニングの場合、同定された新規プロモーターバリアントは、マウスとNHPにおける特異性と強度を決定するために特性評価された。図4は、新規ベクタービルダー(VB)光受容体錐体細胞特異的プロモーターの機能検証結果を示します。
図4. スクリーニングから同定された新規VBプロモーターの機能評価。(A)マウスにおけるVBプロモーターによって発現するNLS-mCherryの錐体特異的発現。NLS-mCherryを発現するVBプロモーターを持つAAV8を網膜下注射で投与した。錐体細胞は錐体細胞マーカーArrestin-C(緑)で標識した。(B)カニクイザルにおけるVBプロモーターより発現するNLS-mCherryの錐体細胞特異的発現。NLS-mCherryを駆動するVBプロモーターを持つAAV8を網膜下注射により投与した。
注文方法
お客様提供のプラスミドライブラリー
お客様によって作製されたライブラリーDNAを使用する場合は、マテリアル提出ガイドラインにしたがってライブラリーDNAを郵送してください。作業遅延やライブラリーのダメージを避けるために、当社のガイドラインに忠実に従った梱包をお願いいたします。お客様から提供されたすべてのマテリアルは、必ずベクタービルダーによる品質検査を受ける必要があり、マテリアル当たり16,000円の検査費用が発生します。マテリアルが品質検査を通過しないとライブラリー構築が開始できないことをご承知おきください。お客様によって作製されたプラスミドライブラリーからライブラリー構築をする場合、当社で最終的なライブラリーの複雑性と均一性の保証はできかねます。




