Vector Systems
レンチウイルスCRISPR転写抑制(dCas9-KRABシステム)ベクター
概要
CRISPR/Cas9ベクターは新しく開発されたゲノム編集ツールのひとつで、素早く効率的にゲノムの標的DNA配列に変異を導入できます。(ZFNやTALENなどもよく使われています)。
Cas9はRNA誘導性DNAヌクレアーゼの一種で、プラスミドやバクテリオファージなど外来遺伝子の侵入を防ぐ原生生物の自然免疫システムの一部です。Cas9は18‐22ntの標的配列と配列特異的な相互作用をするガイドRNA(gRNA)と複合体を形成します。gRNAの標的配列へのハイブリダイゼーションによってCas9はゲノムの標的配列を切断します。
dCas9-KRABシステムはゲノムの遺伝子座で遺伝子発現を抑制できる強力なツールです。dCas9-KRABシステムはCRISPR/Cas9ゲノム編集システムの派生型ですが、改良されたgRNAはゲノム編集ではなく、不活性型Cas9タンパク質(dCas9)を利用してゲノム上の標的サイトで転写抑制複合体形成を誘導できます。dCas9はDNAを切断することはありませんが、gRNAを仲介して標的サイトに結合することが可能です。
dCas9-KRABシステムは2つのコンポーネントから構成され、それぞれが独立したレンチウイルスベクターとして供給されます。ひとつめはgRNA発現ベクターで標的とする遺伝子のプロモーター配列に特異的なgRNAを発現します。もうひとつのdCas9-KRABヘルパーベクターはdCas9と転写抑制因子KRAB(Kruppel-associated boxドメイン)の融合タンパク質を発現します。従来のdCas9-KRABヘルパーベクターと改良が施されたdCas9-KRAB-MeCP2ヘルパーベクターの2種類のヘルパーベクターが用意されています。dCas9-KRAB-MeCP2ヘルパーベクターは2つの転写抑制ドメイン(KRABとMeCP2)をdCas9と融合させており、より強力な転写抑制効果を実現しています。
gRNA発現ベクターはdCas9-KRABヘルパーベクターとdCas9-KRAB-MeCP2ヘルパーベクターのどちらかと一緒に用いられます。それらのベクターが細胞に同時導入されると、gRNAはCRISPR-Cas9複合体を形成、そしてdCas9-KRABもしくはdCas9-KRAB-MeCP2を標的とするDNAサイトに誘引する結果、転写が抑制されます。
当社のレンチウイルスgRNA発現ベクター(dCas9-KRABシステム用)はシングルgRNA発現用とデュアルgRNA発現用を選択できます。シングルgRNA発現ベクターは標的配列特異的なgRNAを発現するヒトU6プロモーターを一つだけ持ちます。デュアルgRNA発現ベクターはヒトU6プロモーターが2つあり、単一のゲノム領域のふたつの標的配列に特異的なgRNAの発現、もしくはふたつの異なるゲノム領域の標的配列それぞれに特異的なgRNAを発現できます。シングルgRNA発現ベクターは一つの標的ゲノムサイトの転写抑制をする従来のCRISPRi用途に適しています。デュアルgRNA発現ベクターは同時に二か所のゲノムサイトの転写抑制ができるので遺伝子相互作用の研究に適しています。デュアルgRNA発現ベクターを利用すると、同じゲノム領域の異なるサイトを標的とするふたつのgRNAを発現させることでより強力な転写抑制効果を実現できます。
当ベクターシステムに関する詳細な情報ついては下記の論文を参照してください
| References | Topic |
|---|---|
| Cell. 154:442 (2013) | Characterization of CRISPRa and CRISPRi systems |
| Nat Methods. 12:1143 (2015) | Characterization of the dCas9-KRAB system |
| Nat Methods. 15:611 (2018) | Dual-gRNA and dCas9-KRAB-MeCP2 based gene repression |
特長
当社のレンチウイルスdCas9-KRABベクターは第3世代レンチウイルスベクターシステムを基に開発されています。当システムはE.coliでの高コピー数複製、高タイターウイルスの作製、広範囲の細胞タイプへの高い形質転換効率とゲノムへの遺伝子導入効率を実現します。ヒトU6プロモーターはgRNAの恒常的かつ高い発現レベルを可能にします。
検証実験
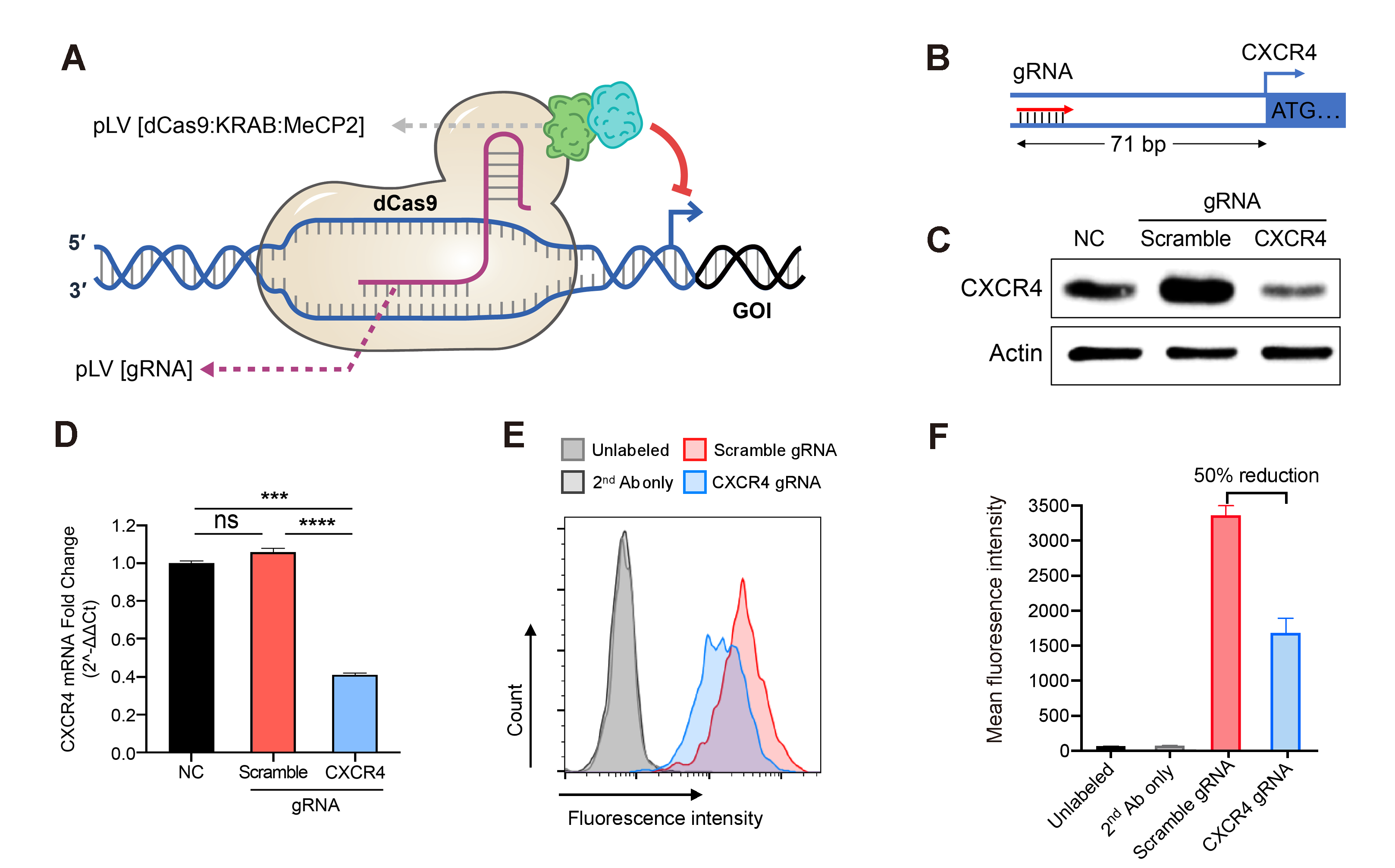
図 1. レンチウイルスを用いたCRISPRiによる遺伝子発現抑制。dCas9/KRAB/MeCP2転写抑制複合体を安定発現するJurkat細胞にgRNA 発現レンチウイルスを感染させ、抗生物質選択を行った。(A) dCas9/KRAB/MeCP2による遺伝子転写抑制の図解。 (B) ヒトCXCR4遺伝子(ケモカインレセプター)のプロモーター領域を標的としたgRNA設計の図。(C)Jurkat 細胞にスクランブルまたはターゲッティングgRNA を導入したもの、または無処理コントロール (NC)のCXCR4遺伝子発現量をqRT-PCR法にて比較測定した結果。Mean±SD, ***P<0.001, ****P<0.0001, Tukey法によるANOVA。(D)Jurkat 細胞にスクランブルまたはターゲッティングgRNA を導入したもの、または無処理コントロール (NC) におけるCXCR4タンパク質発現量をウェスタンブロット法によって比較した結果を示す。(E)スクランブルまたはターゲットgRNAで形質導入されたJurkat細胞膜に発現するCXCR4をフローサイトメトリーで定量化した。CXCR4は、モノクローナル一次抗体 (Ab) および蛍光色素結合型二次抗体で標識した。ネガティブコントロールには、無標識二次抗体と、Jarkat細胞を用いた。 (F) CXCR4をターゲットするgRNAで形質導入された細胞の表面上のCXCR4タンパク質量は、スクランブルgRNAを形質導入された細胞に比較して、平均して約50%減少した。Mean±SD。
メリット
ゲノム配列の改変をしない:dCas9-KRABシステムはゲノム上の標的遺伝子座の転写を不活性化できます。ゲノム編集や外来性遺伝子の導入などとは異なり、ゲノム配列の改変を行うことはありません。
強力な転写抑制:dCas9-KRABシステムは強力な転写抑制を達成できます。
幅広いRNA種に対応:dCas9-KRABシステムはDNAレベルで転写抑制をするので、多様なRNA種(non-coding RNA、 マイクロRNA、アンチセンスRNA、核局在RNA、RNAポリメラーゼ III転写産物など)に対して使用できます。
高い特異性:dCas9-KRABシステムはオフターゲット効果を最小限にして特異性の高い発現抑制効果を得られます。
デメリット
技術的な複雑さ:レンチウイルスベクターはパッケージング細胞によるウイルス作製とタイターの正確な計測などの操作が必要になります。従来のプラスミドを使った遺伝子導入と比べてこれらは高い技術の習熟が必要となり、時間もかかります。
複数ベクターの利用が必須:当ベクターシステムはgRNA発現ベクターとdCas9-KRABヘルパーベクターもしくはdCas9-KRAB-MeCP2ヘルパーベクターが必要になります。
遺伝子ごとの抑制効果のばらつき:dCas9-KRABシステムによる転写抑制効果はクロマチンの状態に依存するために遺伝子ごとにばらつきがあります。
基本コンポーネント
レンチウイルス シングルgRNA発現ベクター
RSV promoter: ラウス肉腫ウイルスプロモーター。ウイルスRNAを転写する。その後ウイルスRNAはウイルスにパッケージングされる。
5’LTR-ΔU3: HIV-1の5‘LTR(long terminal repeat)に欠損を起こしたもの。レンチウイルス野生株の5‘LTRと3' LTRは相同配列をもつ。5‘LTRと3‘LTRはウイルスゲノムの両端に同じ向きで配置される。ウイルスゲノムの挿入過程に3‘LTRの配列は5‘LTRに上書きされる。LTRはプロモーターとポリアデニレーションシグナルの両方の機能があり、野生株では5‘LTRはウイルスゲノムを転写するプロモーターとして、3‘LTRは転写終了させるためのポリアデニレーションシグナルとして機能する。当社のベクターでは、5' LTR-ΔU3はウイルスの転写因子TatがLTRのプロモーターを活性化するために必要な配列が欠損している。しかしながら、5' LTR-ΔU3 上流のRSVプロモーターが代わりにプロモーターとして機能するため、この欠損はパッケージング時のウイルスRNAの生産に影響しない。
Ψ: ウイルスRNAのパッケージングに必要なHIV-1パッケージングシグナル。
RRE: HIV-1 Rev response element。ウイルスRNAのパッケージング時のRevタンパク質によるウイルスRNAの核外輸送に必要。
cPPT: HIV-1 Central polypurine tract。細胞感染中にウイルスゲノムの核内輸送を促進させるためのDNAフラップを形成する。ベクターの宿主ゲノムへの挿入効率を上昇させ、形質転換効率を高める。
U6 promoter: ヒトU6 snRNAのプロモーター。small RNAの転写をするRNAポリメラーゼIIIによってgRNAを高レベルで発現する。
gRNA: Streptococcus pyogenes由来のCas9(SpCas9)用のgRNA。
Terminator: gRNAの転写を停止する。
hPGK promoter: ヒトphosphoglycerate kinase 1 遺伝子プロモーター。下流のマーカー遺伝子を遍在的に発現する。
Marker: 薬剤選択用遺伝子(ネオマイシン耐性など)、視覚化用遺伝子(EGFPなど)、デュアルレポーター遺伝子(EGFP/Neoなど)。ベクターが導入された細胞の薬剤選択もしくは可視化を可能にする。
WPRE: ウッドチャック肝炎ウイルス転写後調節因子。ウイルスRNAの3' LTRでの転写停止を促進してパッケージング細胞でのウイルスRNAを増加させ、高ウイルスタイターを実現する。さらに、マーカー遺伝子 の転写停止も促進することで高い発現レベルを可能にする。
3’LTR-ΔU3: HIV-1の3‘LTRのU3領域に欠損を起こしたもの。ウイルスベクター挿入過程で3' LTRが5' LTRを上書きするために、プロモーター不活性型の5' LTR-ΔU3が宿主ゲノムへ挿入される。3’LTR-ΔU3のポリアデニレーションシグナルはウイルスパッケージング中と宿主ゲノムに挿入後のすべての転写反応を停止させる。
SV40 early pA: SV40(Simian virus 40)のearlyポリアデニレーションシグナル。ウイルスパッケージング時の3' LTRによるウイルスRNA転写停止を補助する。パッケージング細胞でのウイルスRNAを増加させ高ウイルスタイターを実現する。
Ampicillin: アンピシリン耐性遺伝子。 E.coliへのアンピシリン耐性によるプラスミドの維持を可能にする。
pUC ori: pUC複製起点。E.coliでプラスミドを高コピーで維持する。
レンチウイルス デュアルgRNA発現ベクター
RSV promoter: ラウス肉腫ウイルスプロモーター。ウイルスRNAを転写する。その後ウイルスRNAはウイルスにパッケージングされる。
5’LTR-ΔU3: HIV-1の5‘LTR(long terminal repeat)に欠損を起こしたもの。レンチウイルス野生株の5‘LTRと3' LTRは相同配列をもつ。5‘LTRと3‘LTRはウイルスゲノムの両端に同じ向きで配置される。ウイルスゲノムの挿入過程に3‘LTRの配列は5‘LTRに上書きされる。LTRはプロモーターとポリアデニレーションシグナルの両方の機能があり、野生株では5‘LTRはウイルスゲノムを転写するプロモーターとして、3‘LTRは転写終了させるためのポリアデニレーションシグナルとして機能する。当社のベクターでは、5' LTR-ΔU3はウイルスの転写因子TatがLTRのプロモーターを活性化するために必要な配列が欠損している。しかしながら、5' LTR-ΔU3 上流のRSVプロモーターが代わりにプロモーターとして機能するため、この欠損はパッケージング時のウイルスRNAの生産に影響しない。
Ψ: ウイルスRNAのパッケージングに必要なHIV-1パッケージングシグナル。
RRE: HIV-1 Rev response element。ウイルスRNAのパッケージング時のRevタンパク質によるウイルスRNAの核外輸送に必要。
cPPT: HIV-1 Central polypurine tract。細胞感染中にウイルスゲノムの核内輸送を促進させるためのDNAフラップを形成する。ベクターの宿主ゲノムへの挿入効率を上昇させ、形質転換効率を高める。
U6 promoter: ヒトU6 snRNAのプロモーター。small RNAの転写をするRNAポリメラーゼIIIによってgRNAを高レベルで発現する。
gRNA #1: Streptococcus pyogenes由来のCas9(SpCas9)用のgRNA#1。
gRNA #2: Streptococcus pyogenes由来のCas9(SpCas9)用のgRNA#2。
Terminator: gRNAの転写を停止する。
hPGK promoter: ヒトphosphoglycerate kinase 1 遺伝子プロモーター。下流のマーカー遺伝子を遍在的に発現する。
Marker: 薬剤選択用遺伝子(ネオマイシン耐性など)、視覚化用遺伝子(EGFPなど)、デュアルレポーター遺伝子(EGFP/Neoなど)。ベクターが導入された細胞の薬剤選択もしくは可視化を可能にする。
WPRE: ウッドチャック肝炎ウイルス転写後調節因子。ウイルスRNAの3' LTRでの転写停止を促進してパッケージング細胞でのウイルスRNAを増加させ、高ウイルスタイターを実現する。さらに、マーカー遺伝子の転写停止も促進することで高い発現レベルを可能にする。
3’LTR-ΔU3 : HIV-1の3‘LTRのU3領域に欠損を起こしたもの。ウイルスベクター挿入過程で3' LTRが5' LTRを上書きするために、プロモーター不活性型の5' LTR-ΔU3が宿主ゲノムへ挿入される。3’LTR-ΔU3のポリアデニレーションシグナルはウイルスパッケージング中と宿主ゲノムに挿入後のすべての転写反応を停止させる。
SV40 early pA: SV40(Simian virus 40)のearlyポリアデニレーションシグナル。ウイルスパッケージング時の3' LTRによるウイルスRNA転写停止を補助する。パッケージング細胞でのウイルスRNAを増加させ高ウイルスタイターを実現する。
Ampicillin: アンピシリン耐性遺伝子。 E.coliへのアンピシリン耐性によるプラスミドの維持を可能にする。
pUC ori: pUC複製起点。E.coliでプラスミドを高コピーで維持する。



