Beta Late Than Never
キーワード: Zynteglo gene therapy, Beta thalassemia
βサラセミアは赤血球内で酸素の運搬に関わるヘモグロビンに異常がある遺伝子疾患です。βサラセミア患者はヘモグロビンサブユニットのβグロブリンに変異があるために酸素運搬能力が低下し、貧血の症状を持ちます。βサラセミアの症状は軽度から重度まで様々ですが、重度の場合は生涯にわたって輸血と鉄キレート療法が必要になります。
成人性ヘモグロビン(HbA)は、4つのポリペプチド(それぞれ2つのα鎖とβ鎖)から構成される4量体の構造をとります。これらのポリペプチドは3つの遺伝子座HBA1, HBA2, HBBにコードされています。16番目の染色体に位置するHBA1とHBA2はほぼ同一配列のα鎖をコードし、11番目の染色体にあるHBBはβ鎖をコードしています。HBB遺伝子座の変異がβサラセミアの原因となり、親から子へと遺伝します。また、特定の集団に応じて変異のタイプは異なります。BOサラセミアはスプライシングサイトに変異を持つためにβグロブリン鎖が生産されなくなり、B+サラセミアはC>T変異によってβグロブリン鎖の発現が減少します。
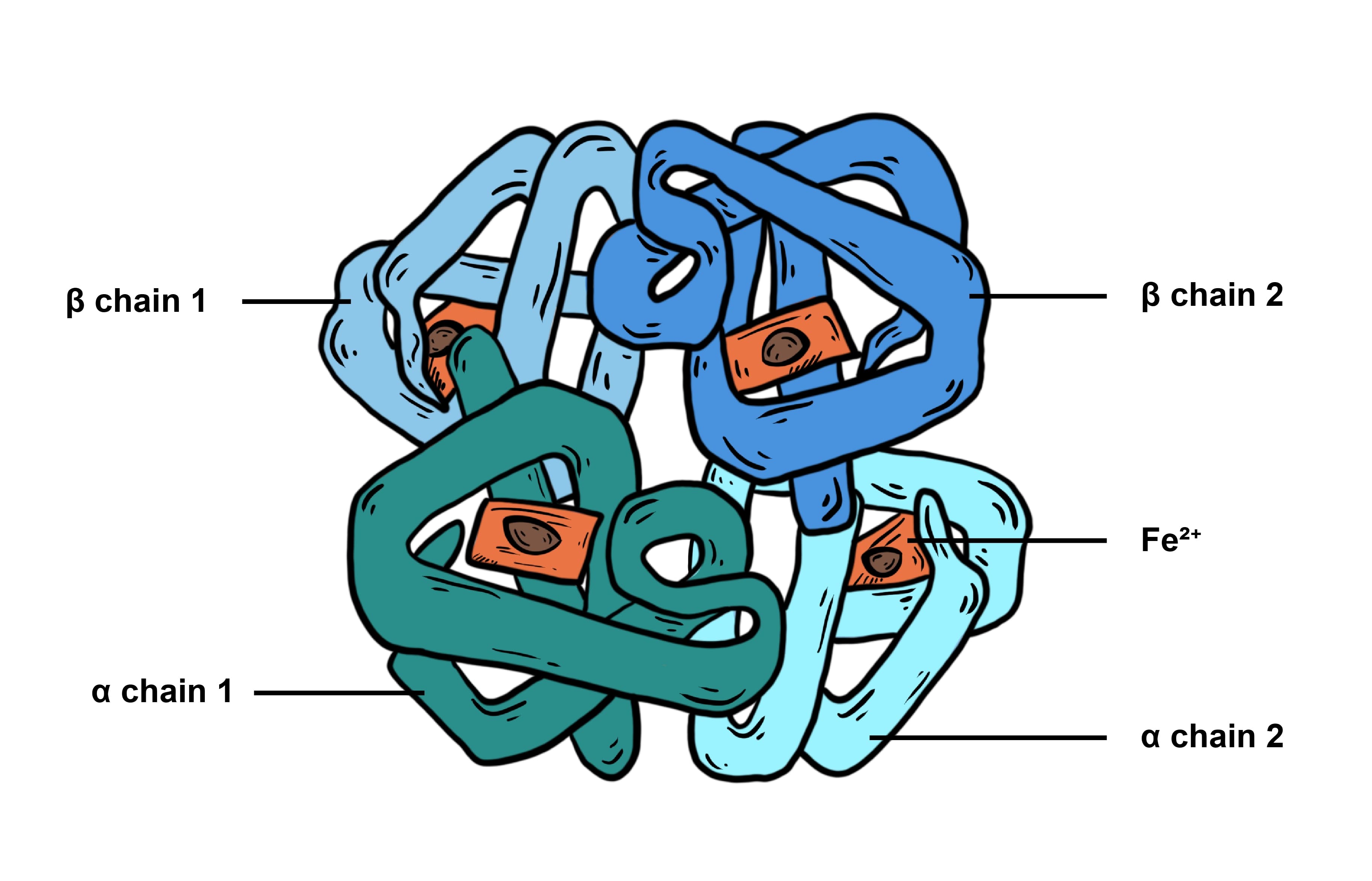
図1. 成人性ヘモグロビンの模式図"
Zyntegloの開発
遺伝子治療はβサラセミアの治療にとても有望と考えられています。βサラセミアの遺伝子治療法であるZyntegloは2019年にEUで、2022年に米国で承認されました。Zyntegloの治療プロセスは医薬品を患者に投与する一般的な治療法とは異なっています。始めに、患者から採取された血液幹細胞はZynteglo施設に輸送されます。次に改変βグロブリン遺伝子を血液幹細胞に組み込むことができるレンチウイルスベクターであるZyntegloをトランスダクションし、患者由来の血液幹細胞に正常なβグロブリンを発現させます。適切な品質管理基準を満たした遺伝子導入細胞が十分量用意できるまでにおよそ70-90日が必要になります。
Zynteglo処置された血液幹細胞を患者に戻す前に、患者は変異βグロブリン遺伝子を持つ骨髄細胞を取り除くために化学療法を受ける必要があります。化学療法が終了した後、Zynteglo処置された血液幹細胞は骨髄移植によって患者の体内に戻されます。このβサラセミア治療は一回だけで十分です。移植された血液幹細胞は患者の体内で増殖、分化し、生涯にわたって正常な血球細胞を提供し続けます。
Zyntegloの第3相臨床試験において安全性と輸血の必要性、血中ヘモグロビン値、血中量鉄分の減少などの治療効果が検証されました。報告時点で最大39ヶ月間にわたって(継続中)、第3相臨床試験は91%の患者において輸血の必要性の消失、ほぼ正常なヘモグロビン値など良好な結果をもたらしています。またほとんどの患者に鉄キレート療法が必要がなくなっています。この結果はβサラセミアの治療にZyntegloが非常に有効であることを示しており、遺伝子治療分野の有用性の証左となっています。
最適化してより効果的に
βサラセミアにおいて、HBB遺伝子の変異がβグロブリンの減少もしくは欠損の原因となり、ヘモグロビン中のα鎖とβ鎖のバランスを破壊します。バランスを失うことによってグロブリンα鎖の凝集や重合が起こることで赤血球細胞の崩壊、貧血症状、そして合併症につながります。野生型のHBB遺伝子の導入が必ずグロブリン鎖のバランスを修正できるわけではありません。Zyntegloに組み込まれたHBB遺伝子にはT87Q変異が導入されており、酸素の運搬量に影響を与えずにグロブリン鎖の重合を防ぐことが出来ます。これによって細胞は正常な機能を回復できます。
効果的な治療法であるZyntegloの他の重要機能は独自のBBV305 LVVプロモーターにあります。この非ウイルス由来のプロモーターは赤血球系の細胞特異的に活性化し、赤血球とその前駆体細胞でのみ遺伝子発現を誘導します。細胞系統特異的なプロモーターを使用することは特定の組織・細胞をターゲットにする遺伝子治療法のデザインに非常に重要です。
Zyntegloの費用は患者あたり約280万ドルと報告されています。この高額な費用については遺伝子治療が人々の手に届くのか、命に係わる医療技術についてほとんどの患者が支払うことができない価格に設定することに対する倫理性など、世界中で大きな議論を呼び起こしています。ブルーバード・バイオ社は、高額な研究開発費用と一回の処置で生涯にわたる疾患を治療できる長期的な価値を鑑みれば、この価格を妥当なものであると主張しています。例えば、周期的な輸血と薬剤投与が必要な患者の医療値は12万7000ドル/年となります。どちらにしてもZyntegloの価格は患者とヘルスケアシステムにとって非常に大きなものとなっています。
別のアプローチは?
βサラセミア遺伝子治療へのアプローチとしてグロブリン遺伝子の置き換え以外の方法も検討されています。遺伝子機能の不具合に対応し、正常なβグロブリン鎖の生産を促進することに注力しています。レンチウイルスによる外来性遺伝子のゲノム挿入を必要としないで、変異HBB遺伝子を直接的に修正するCRISPR/Cas9遺伝子編集が検討されていますが、βサラセミアには様々なHBB変異が関わるため、この方法は各患者レベルでの処置をカスタマイズすることが必要になります。
CRISPR/Cas9によってβサラセミアの原因となる変異を修復する試みとは別に、胎児性ヘモグロビンの発現を再活性化させる試みも臨床レベルで検討されています。胎児性ヘモグロビンは妊娠後6週間から生後6ヵ月のあいだ発現し、その後に急速に発現が減少します。γヘモグロビン鎖をコードするHBG1とHBG2遺伝子は胎児性のヘモグロビンにおいてβ鎖の代わりに存在し、転写抑制因子BCL11Aによって発現抑制されます。CRISPR/Cas9によってCTX001は患者由来の幹細胞のBCL11Aを抑制する遺伝子治療です。この遺伝子治療によって、高いレベルの特異的編集と胎児性ヘモグロビンの増加、さらに輸血の非依存性などが初期の臨床試験で観察されています。
さいごに
βサラセミアはヘモグロビン量の減少をもたらす単発性の疾患で、継続的な輸血と鉄キレート療法が必要になります。βサラセミアの遺伝子治療は承認されており、新しい治療法も研究されています。これらの治療法はβサラセミア患者の生活を大きく向上させる可能性がありますが、その高額な費用のために、すべての患者の手に届くかどうかはまだわかりません。
参考文献
1.https://www.zynteglohcp.com/?gclid=Cj0KCQjwr82iBhCuARIsAO0EAZwrryklOjNqPymWkVJyN20ikNIwJFiOmWA9LwdzKSsgibIZaeXXowoaAtixEALw_wcB
2. Negre O, Eggimann AV, Beuzard Y, Ribeil JA, Bourget P, Borwornpinyo S, Hongeng S, Hacein-Bey S, Cavazzana M, Leboulch P, Payen E. Gene Therapy of the β-Hemoglobinopathies by Lentiviral Transfer of the β(A(T87Q))-Globin Gene. Hum Gene Ther. 2016 Feb;27(2):148-65. doi: 10.1089/hum.2016.007. PMID: 26886832; PMCID: PMC4779296.
3. https://www.valueinhealthjournal.com/article/S1098-3015(18)32072-2/fulltext
4. Frangoul H, Altshuler D, Cappellini MD, Chen YS, Domm J, Eustace BK, Foell J, de la Fuente J, Grupp S, Handgretinger R, Ho TW, Kattamis A, Kernytsky A, Lekstrom-Himes J, Li AM, Locatelli F, Mapara MY, de Montalembert M, Rondelli D, Sharma A, Sheth S, Soni S, Steinberg MH, Wall D, Yen A, Corbacioglu S. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med. 2021 Jan 21;384(3):252-260. doi: 10.1056/NEJMoa2031054. Epub 2020 Dec 5. PMID: 33283989.



