IVT RNA医薬品開発
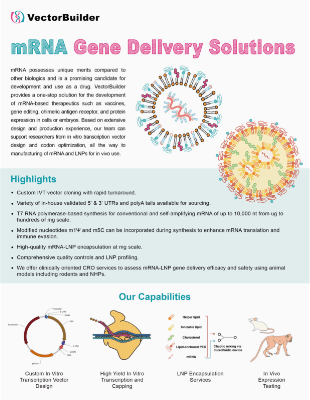
ベクタービルダーは、ワクチン、遺伝子置換、キメラ抗原受容体(CAR)、遺伝子編集を含むRNA治療薬開発のための包括的なプラットフォームを提供しています。弊社の専門チームは、既製品RNAやカスタムRNAに関する豊富な設計・製造経験を持ち、様々なRNAベースの発現系のためのin vitro transcription (IVT)RNA合成や脂質ナノ粒子(LNP)カプセル化のサポートを提供しています。弊社のCROサービスは、in vitro/in vivo候補スクリーニングや機能試験を提供することによって、RNA治療薬の開発を加速できます。下のリンクをクリックして、ベクタービルダーの豊富な検証データをご覧ください。
特長
 包括的なプラットフォーム 研究および臨床グレードのRNA、様々なRNA発現システム、カスタマイズ可能なIVT RNA生産およびLNPカプセル化、CRO/CDMOのフルサービスを提供。
包括的なプラットフォーム 研究および臨床グレードのRNA、様々なRNA発現システム、カスタマイズ可能なIVT RNA生産およびLNPカプセル化、CRO/CDMOのフルサービスを提供。 RNA開発の専門チーム ベクタービルダーのチームは、IVTベクターの最適化、配列およびコンポーネントのスクリーニング、製造開発など、治療デザインに関して検討すべきあらゆる事項について豊富な専門知識を有する一流の科学者や研究者で構成されています。
RNA開発の専門チーム ベクタービルダーのチームは、IVTベクターの最適化、配列およびコンポーネントのスクリーニング、製造開発など、治療デザインに関して検討すべきあらゆる事項について豊富な専門知識を有する一流の科学者や研究者で構成されています。 最高の品質と再現性 最先端の設備を備えた施設において、フルパネルの品質管理アッセイによって保証された最高の純度とバッチ間の一貫性を提供します。
最高の品質と再現性 最先端の設備を備えた施設において、フルパネルの品質管理アッセイによって保証された最高の純度とバッチ間の一貫性を提供します。