明るく輝く小さな細胞:適切なレポーター遺伝子を選択するために
概要
活性の直接測定が困難な目的遺伝子の発現や制御因子の活性を研究するために、容易に検出・定量できる分子が分子生物学においてレポーターとして利用されています。レポーターには様々なタイプがありますが、生物学研究においては蛍光タンパク質(FP)、ルシフェラーゼ、β-ガラクトシダーゼが最もポピュラーなレポーターとして知られています。どのレポーターを採用するのかは、定量的もしくは定性的なデータを得たいのか、生細胞もしくは固定した組織を使用するのかなど、実験条件に大きく依存します。この場を借りて3種のレポーターについて掘り下げることで、特定のニーズにとって最適なレポーターを選択するための流れを説明したいと思います。
レポーター遺伝子を目的の細胞に導入するためには、プラスミドのトランスフェクションや組み換えウイルスまたはmRNAが使用されます(図1)。
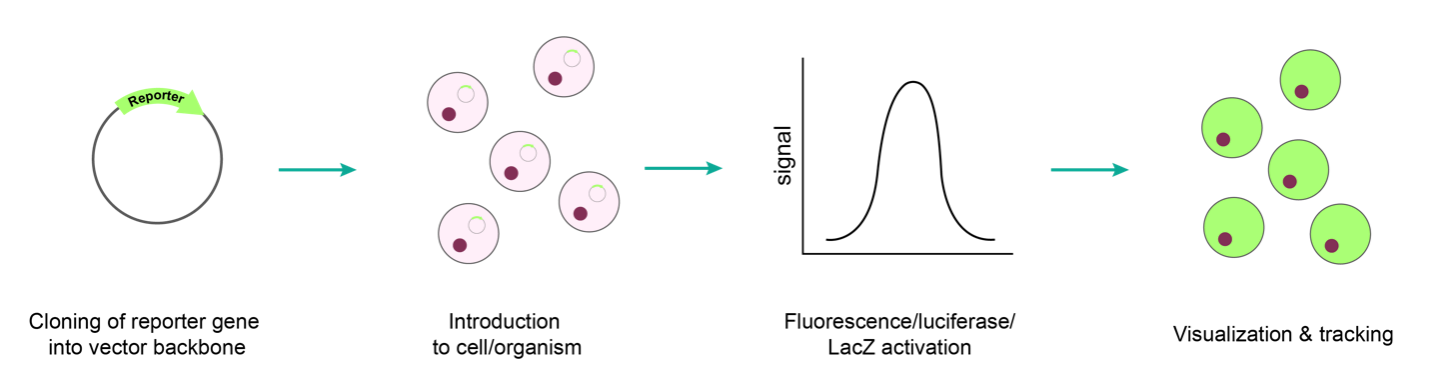
図1 レポーター遺伝子の発現ワークフロー
レポーターを適切に選ぶことだけでなく、研究目的に合致したレポーター遺伝子を搭載したベクターのデザインも重要です。いくつかの例を紹介します。
1. 特定の組織や細胞で目的プロモーターが活性化しているかどうかを調べたい。適切なベクターシステム上で、レポーター遺伝子は組織/細胞特異的プロモーターの下流に配置されます。
2. 実験刺激後に目的タンパク質レベルはどう変化するのかを調べたい。目的タンパク質レベルの直接検出が困難なケースでは、適当なベクターシステム上でレポーター遺伝子は目的遺伝子にリンカーを介して連結されて融合タンパク質として発現されます。リンカーについての情報はこちらから。
3. プロモーターの活性強度を測定したい。定量可能なレポーター遺伝子をプロモーター下流に配置して、レポーター遺伝子の発現量を元にしてプロモーター活性を評価します。
実験に最適なレポーター遺伝子を搭載したベクターのデザインに迷ったら、ベクタービルダーにお問い合わせください。
蛍光タンパク質レポーター
クラゲから同定された緑色蛍光タンパク質(GFP)は様々な生物で活用され、分子生物学の発展に多大な貢献をしています。GFPは様々な真核生物細胞で機能し、従来の蛍光顕微鏡によって容易に観察できることによって、遺伝子発現パターン、細胞内局在、その他の細胞プロセスの研究に使用されています。
GFPの発見以来、他色の蛍光タンパク質も同定され、生物学研究に利用されています。ポピュラーな例としては、強い赤色光を発する赤色蛍光タンパク質(RFP)のmCherry;GPFから派生した黄色発光する黄色蛍光タンパク質(YFP);青色蛍光タンパク質(BFP)のtagBFP2があります。これら以外の多数(!)の蛍光タンパク質についてはベクタービルダーの蛍光タンパク質ガイドをご覧ください。
蛍光タンパク質は、生細胞や生物の細胞や分子の動態をリアルタイムで見ることができる理想的なレポーターシステムです。通常、LacZやルシフェラーゼは1種のシグナルに限定されますが、蛍光タンパク質は幅広い色調を持つために複数の細胞構造を同時に可視化でき、複数対象の研究が容易になります。しかしながら、蛍光タンパク質は退光(励起による蛍光の消失)や自家蛍光の問題もあり、使用が限定されるケースもあります。ベクタービルダーによるこの記事では、シングル/マルチカラー観察及び蛍光共鳴エネルギー移動(FRET)実験を含む様々なアプリケーションに要求される、蛍光強度、成熟速度、光安定性やスペクトル特性などを最適化するための詳細な情報を提供します。加えて、ゼブラフィッシュのレポーター実験に使用するEGFP mRNAを配列エンジニアリングによって最適化した例を紹介します。
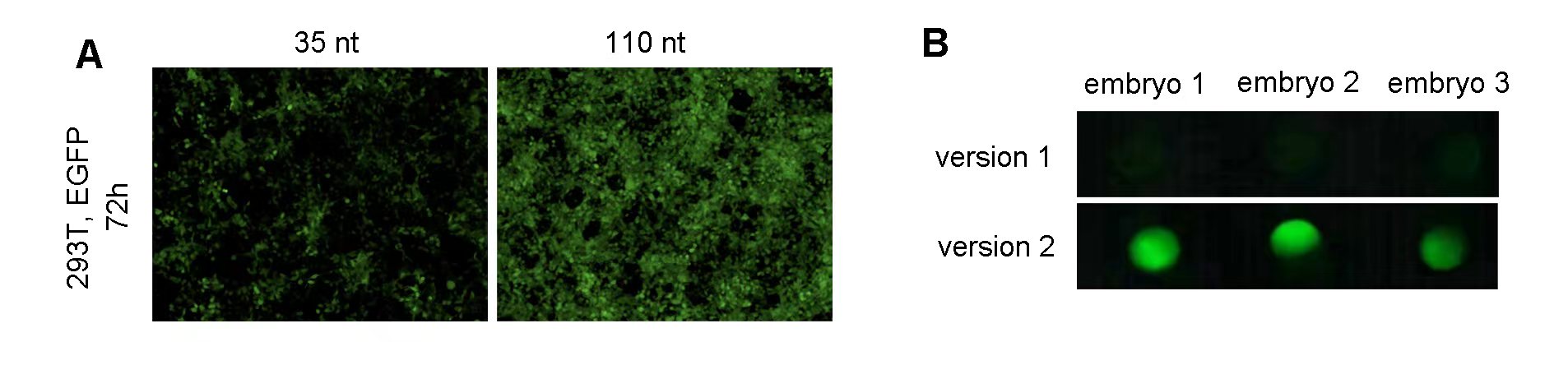
図2(A)12ウェルプレート内の293T細胞に、1ウェルあたり1ugのゼブラフィッシュEGFP mRNAをトランスフェクションした。110 ntのpolyAを持つmRNAをトランスフェクション後72時間経過した細胞は、in vitroでのより高いEGFP発現量を示す。(B) ゼブラフィッシュEGFP IVT mRNA 250 pgを1細胞期のゼブラフィッシュ胚にマイクロインジェクションした6時間後、EGFP発現によって選別した。Kozak配列を最適化(バージョン 2)することによって、in vivoでEGFP発現が増加することが確認された。
ルシフェラーゼレポーター
生物発光の研究は1900年代初頭に発光生物の実験から始まり、生物発光が酵素(ルシフェラーゼ)と基質(ルシフェリン)の化学反応として測定が容易な現象であることが発見されました。ルシフェラーゼレポーターアッセイは、導入遺伝子発現の測定法として非常にポピュラーとなっています。ルシフェラーゼアッセイは、ルシフェラーゼ酵素の活性を生物発光として測定します。ルシフェラーゼは、ATPと酸素の存在下で特異的基質ルシフェリンに作用します。ルシフェリンの酸化反応から放出される光は、ルミノメーターを用いて測定・定量します。発光強度はルシフェラーゼ酵素量と正比例するため、遺伝子発現レベルを正確に定量することが可能です。
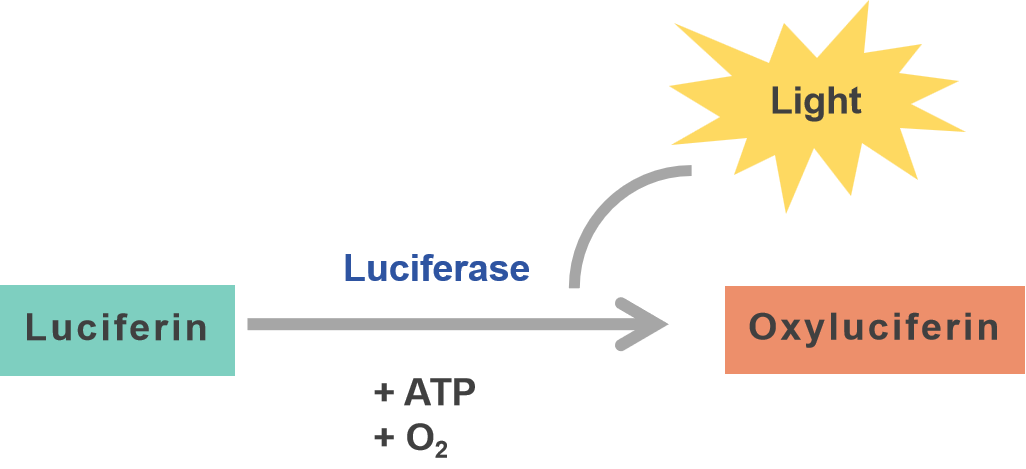
ルシフェラーゼの大きな利点は、バックグラウンドシグナルが最小であるために高感度の定量が可能です。しかしながら、ルシフェラーゼアッセイには基質の添加が必要であり、シグナルが一過性となるために長期的な観察には適していないかもしれません。ルシフェラーゼも同様に、コドンの最適化を含む配列のエンジニアリングによる最適化が可能です。ベクタービルダーはHiExpress™ IVTホタルルシフェラーゼmRNAの配列最適化によって、高い発現量を達成しました(図3)。
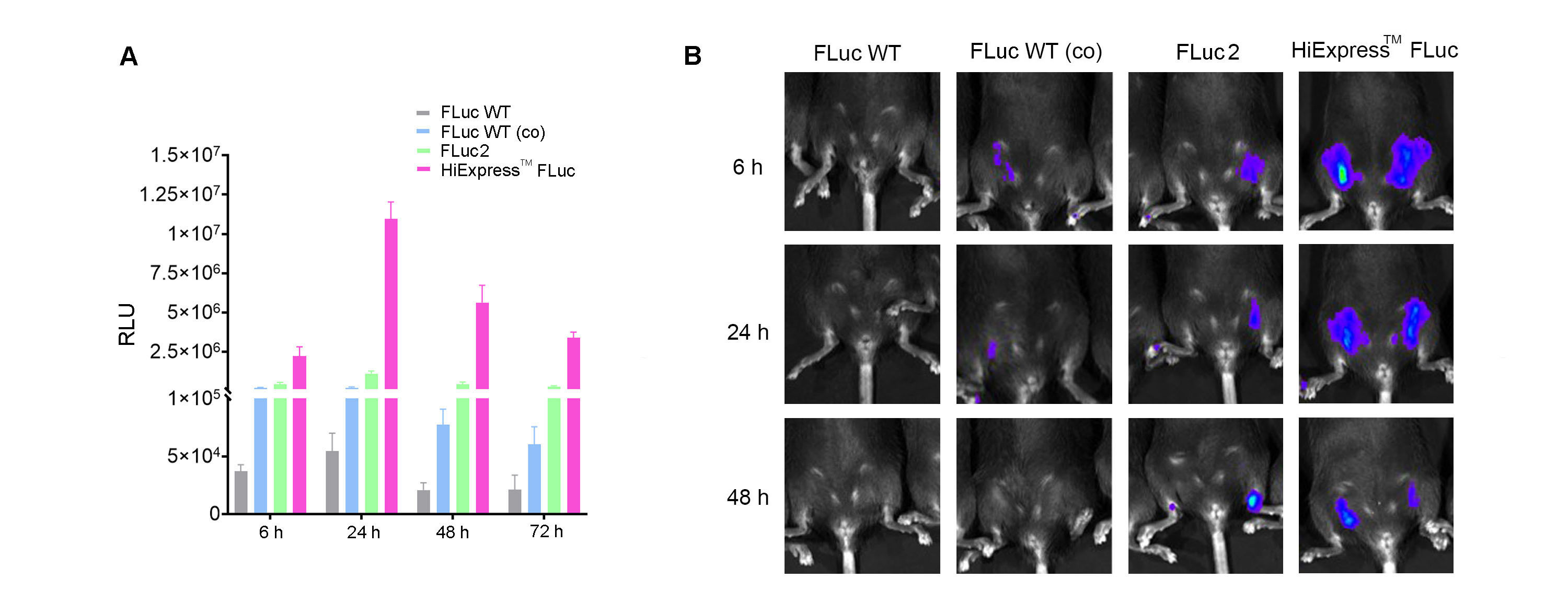
図3 (A) HEK293T細胞におけるHiExpress™ホタルルシフェラーゼmRNAおよび他のルシフェラーゼmRNAの発現量比較。12ウェルプレートで培養中の細胞を1ウェルあたり0.5ugのmRNAでトランスフェクションして6時間、24時間、48時間、72時間後に、ルシフェラーゼ活性を測定した。(B) 成体C57BL/6マウスに30ug LNPカプセル化mRNAを筋肉内注射したあと6時間、24時間、48時間後にルシフェラーゼ活性を測定した。FLuc WTは野生型ホタルルシフェラーゼ、FLuc WT(co)はコドン最適化された野生型ホタルルシフェラーゼ、FLuc2はLuc2ホタルルシフェラーゼを示す。
β-galactosidase/ LacZレポータ-システム
大腸菌のラクトース代謝に必要な酵素β-ガラクトシダーゼ(β-gal)をコードするlacZ遺伝子は、初期の転写制御研究において極めて重要な酵素でした。詳細なlacZ遺伝子の研究によって、lacZは生物学研究におけるレポーター遺伝子として広く採用されるようになりました。ラクトースを分解する4量体酵素であるβ-galは、ラクトース誘導体であるX-galに作用して、酵素活性の検出に利用できる青色の反応副生成物を生み出します。β-galの発現は、宿主細胞にX-galを添加することによって観察が可能になり、細胞が示す青色色素が遺伝子発現を識別するための指標として使用されます。LacZシステムは、主にクローニング実験における組換えバクテリアの陽性クローンの同定や、様々な生物におけるプロモーター活性の検証に用いられています。さらに、標的遺伝子をlacZ遺伝子と融合させることでタンパク質の局在、タンパク質間相互作用、Cre応答性FLEXエレメントのようなコンポーネントの遺伝子発現への影響を調べることも可能になります。
β-gal/LacZは費用対効果が高く、高いシグナル対ノイズ比をもつ酵素活性のために、高感度の遺伝子発現レポーターとなります。バクテリアから哺乳類細胞まで、非常に多くの生物種にて使用できます。またLacZは無毒であるため、細胞や生体における遺伝子発現の研究にも使用可能です。しかし、β-galアッセイを生細胞や生体で行うのは複雑になりがちで、多くのケースでは細胞の溶解や細胞や生体の固定が必要になります。さらに、β-galアッセイは蛍光タンパク質やルシフェラーゼアッセイに比べると定量性に劣ります。
まとめ
| レポーターシステム | 反応タイプ | ポピュラーな使用例 | 利点 | 限界 |
|---|---|---|---|---|
| 蛍光タンパク質 | 非酵素反応 |
|
|
|
| ルシフェラーゼ | 酵素反応 |
|
|
|
| β-ガラクトシダーゼ(LacZ) | 酵素反応 |
|
|
|
それぞれのレポーターシステムの利点を活用して異なるレポーターを実験に併用できれば、より深い生物学的知見を得ることができます。例えば、複数のレポーターを異なる細胞区画(例えば、ひとつは核、もうひとつは細胞質など)で利用すれば、より正確な局在研究が可能になります。レポーター間の干渉を避けながら複数レポーターを併用して、正確なデータの解釈を実現するためには、実験デザインを慎重に行う必要があります。
キーワード : レポーター遺伝子、蛍光タンパク質、ルシフェラーゼ、β-ガラクトシダーゼ、GFP、RFP、YFP、mCherry、BFP、レポーター遺伝子のクローニングと発現、生物発光イメージングツール、プロモーター活性評価、遺伝子発現のためのベクターデザイン、in vivoおよびin vitroレポーター遺伝子アッセイ、定量的・定性的解析。
参考文献
1. Kremers, Gert-Jan, Sarah G. Gilbert, Paula J. Cranfill, Michael W. Davidson, and David W. Piston. 2011. "Fluorescent Proteins at a Glance." *Journal of Cell Science* 124 (2): 157–160.
2. Chudakov, Dmitriy M., Mikhail V. Matz, Sergey Lukyanov, and Konstantin A. Lukyanov. 2010. "Fluorescent Proteins and Their Applications in Imaging Living Cells and Tissues." *Physiological Reviews* 90 (3): 1103–1163.
3. Cranfill, P., B. Sell, M. Baird, et al. 2016. "Quantitative Assessment of Fluorescent Proteins." *Nature Methods* 13: 557–562.
4. Yeh, H.W. and H.W. Ai. 2019. "Development and Applications of Bioluminescent and Chemiluminescent Reporters and Biosensors." *Annual Review of Analytical Chemistry* (Palo Alto, Calif) 12 (1): 129–150. [https://doi.org/10.1146/annurev-anchem-061318-115027](https://doi.org/10.1146/annurev-anchem-061318-115027). Epub 2019 Feb 20. PMID: 30786216; PMCID: PMC6565457.
5. Zambito, Giorgia, Chintan Chawda, and Laura Mezzanotte. 2021. "Emerging Tools for Bioluminescence Imaging." *Current Opinion in Chemical Biology* 63: 86–94. ISSN 1367-5931. [https://doi.org/10.1016/j.cbpa.2021.02.005].
6. Sharma, Shiv K., Sijan Poudel Sharma, and Roger M. Leblanc. 2021. "Methods of Detection of β-galactosidase Enzyme in Living Cells." *Enzyme and Microbial Technology* 150: 109885. ISSN 0141-0229. [https://doi.org/10.1016/j.enzmictec.2021.109885].
7. Sedzro, DM, SMF Bellah, H Akbar, and SMS Billah. 2018. "Structure, Function, Application and Modification Strategy of β –Galactosidase." *Journal of Multidisciplinary Research Review* 1 (1): 10–16.



