精密な遺伝学:Cre-loxツールボックスを使いこなす
Cre-Loxシステムは、遺伝子発現の精密な制御と遺伝子改変を可能にする遺伝子工学のツールです。このシステムは、主に2つの要素: CreリコンビナーゼとloxPサイトで構成されています。この記事では、この2つの主要な構成要素について概説し、それらが研究室で日々どのように活用されているかについて述べます。システムの概要を説明した後、システム自体の進歩と、このシステムがどのようにさらなる発見に利用されているかについて掘り下げていきます。
“Causes recombination” – “locus of crossover(x) P1”(Cre-loxP)
CreリコンビナーゼはP1バクテリオファージ由来の酵素で、Cre-loxシステムの中心的役割を担っています。Creという頭字語は当初、「組換えを引き起こす(Causes recombination)」という言葉に由来していましたが、今日では「環化リコンビナーゼ」という短縮形でも呼ばれています。この酵素は、loxPサイトとして知られる特定のDNA配列を認識し、それと相互作用する特有の性質を持っています。
LoxPサイトとは、"locus of crosssover (x) P1 "の略で、8塩基対のコア配列スペーサー領域で区切られた2つの13塩基対のインバーテッドかつパリンドローム・リピート(逆位反復配列)からなる特定のDNA配列です。Creは部位特異的リコンビナーゼであり、13塩基対のインバーテッド・リピートを認識し、コア領域の配列がCre-loxシステムに方向性を与えます。2つのloxPサイトが逆方向を向いていると、Creリコンビナーゼは2つのサイト間のDNAセグメントを反転させます。逆に、2つのloxPサイトが同じ方向でDNAセグメントを挟むと、Creリコンビナーゼはサイト間のセグメントを切除し、遺伝情報を欠失させる。ゲノムの異なる場所に同じ方向を向いたloxPサイトを対にすると、転座が可能になります(図1)。
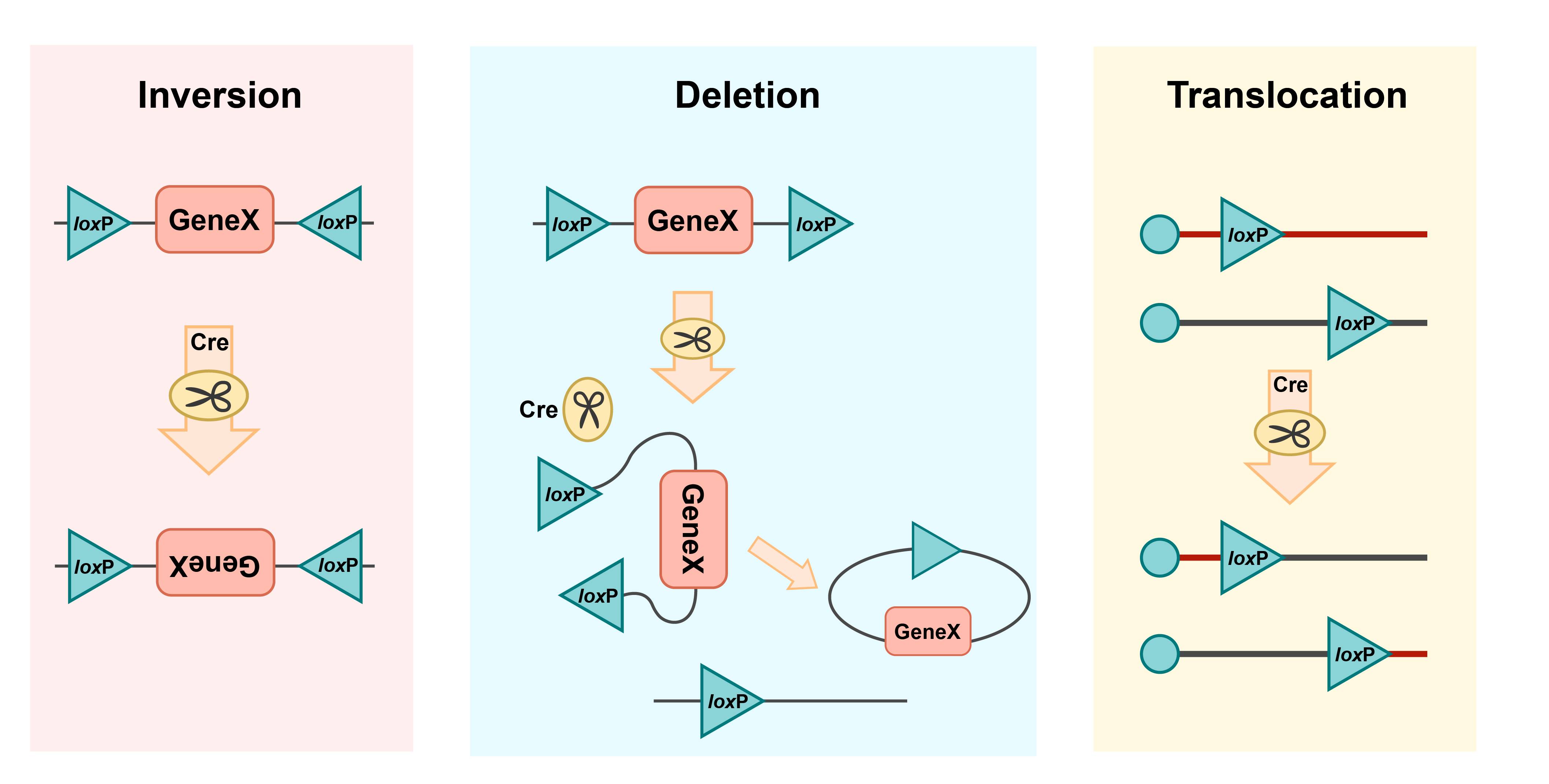 図1. Cre-lox システムによる組み換えのメカニズム
図1. Cre-lox システムによる組み換えのメカニズム
Cre-loxシステムのユニークな特性は、遺伝子工学におけるいくつかの技術への応用を可能にしています。Cre-loxシステムの最も一般的な応用例の1つは、トランスジェニックマウスの作製における使用です。マウスでは、Cre-loxシステムは条件付き遺伝子操作のツールとして広く用いられています。研究者は、標的遺伝子の周囲にloxPサイトを戦略的に配置したマウスを作製し、「フロックス化」遺伝子を作り出します。これらのマウスを、特定のプロモーターの制御下でCreリコンビナーゼを発現するトランスジェニックマウスと交配させ、遺伝子改変の空間的・時間的制御を可能にします(図2)。Creが特定の組織あるいは特定の発生段階で活性化されると、loxPサイトでの組換えを触媒し、標的遺伝子を正確に改変します。これにより、条件付きで遺伝子のノックアウト、活性化、その他の改変が可能となり、制御されたダイナミックな方法で遺伝子機能についての知見を得ることができます。マウスのCre-loxシステムは、遺伝子機能の理解や疾患のモデル化、また治療薬開発を検討する上で、高精度で非常に有効な手法であることが立証されてきました。
例えば、癌抑制遺伝子p53の条件付きノックアウトモデルにより、研究者はゲノムの安定性を維持し、制御不能な細胞増殖を防ぐ役割を探求することができます。Cre-lox技術によってKRASのような癌遺伝子の活性化し、腫瘍の発生と進行に対する特異的な役割を研究することができます。PTEN、BRCA1/BRCA2、E-カドヘリンなどの遺伝子の条件付きノックアウトモデルでは、乳癌、卵巣癌、大腸癌など、さまざまな癌におけるそれらの役割についての知見を得ることができます。これらのモデルは、組織特異的あるいは時間的に制御された方法で特定の遺伝子を標的として操作することを可能にすることで、がん発生の根底にある複雑な分子メカニズムを解明し、新規の治療的介入を前臨床的に試験するための貴重なツールとして役立っています。
マウス系統での利用に加えて、Cre-loxシステムは、遺伝子操作制御のためにin vitroでもよく利用されます。このアプローチにより、研究者はloxPサイトを含むプラスミド(DNA構築物)などの非ウイルス性ベクターを利用することができ、培養細胞や細胞株への導入がより容易になります。これらのloxP-flank配列は、目的の遺伝子、レポーター遺伝子、あるいは他の機能的要素を持つように操作することができます。その後、Creリコンビナーゼを発現する別のベクターで細胞をトランスフェクトすることができます。細胞内にCreが存在すると、loxPサイト間で部位特異的組換えが起こり、目的とする遺伝子改変が生じます。
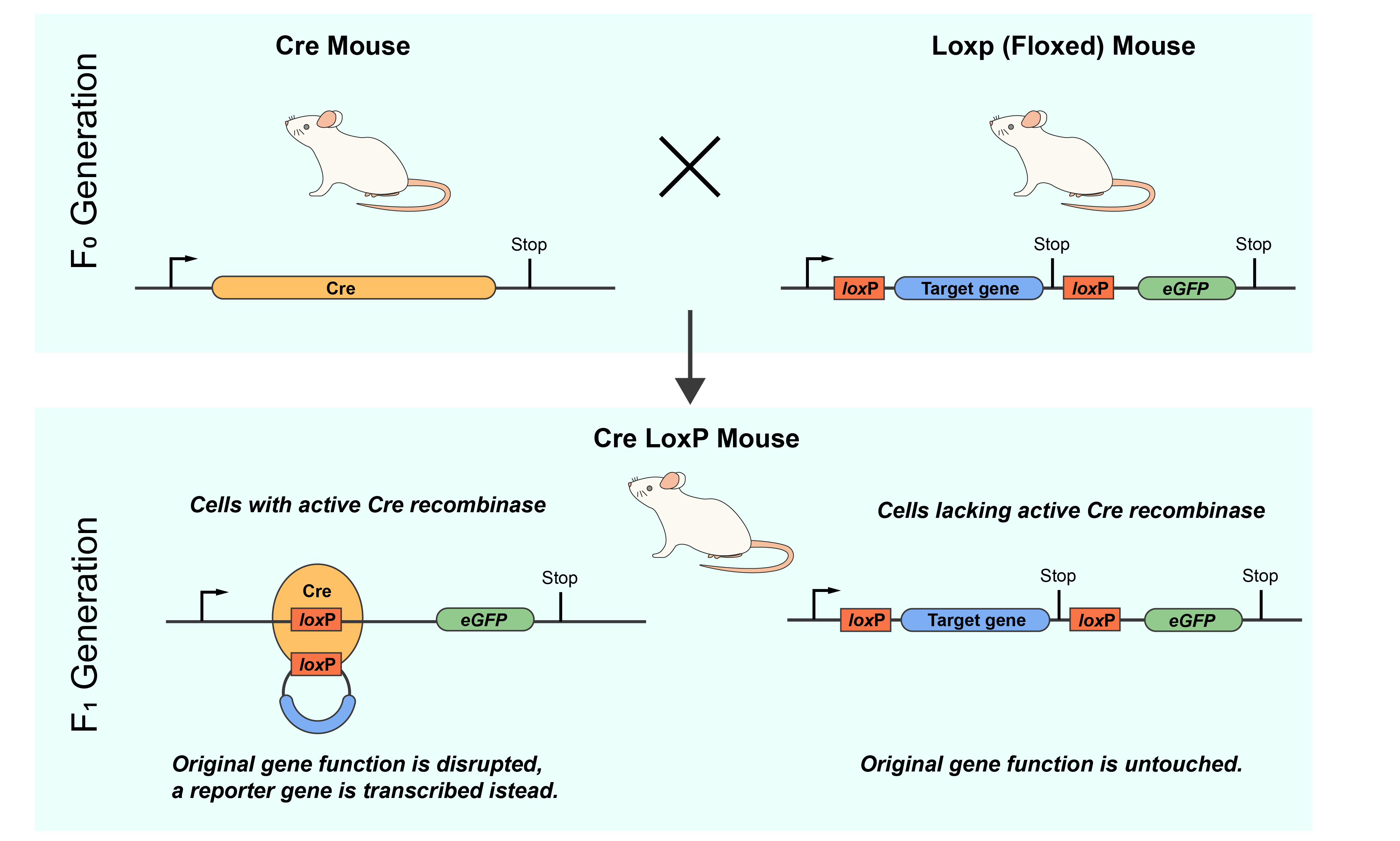 図2. Cre-lox システムを用いた組織特異的ノックアウトマウスの作製
図2. Cre-lox システムを用いた組織特異的ノックアウトマウスの作製
FLEX-ing a little
FLEXスイッチとしても知られるCre-lox FLEXシステムは、従来のCre-loxシステムをさらに発展させたもので、遺伝子組み換えの柔軟性と制御性を高めるように設計されています。FLEXとは、"FLip-EXcision"の略です。Cre-lox FLEXシステムでは、Creリコンビナーゼは「FLEX」サイトと呼ばれる改変されたloxPサイトとともに使用されます。これらの部位は、非対称な方向とフランキング配列をさらに追加した配列を持つように設計されており、双方向かつ可逆的な遺伝子改変を可能にします。FLEXシステムは、遺伝子発現を時間的に制御するのに特に有用です。Creリコンビナーゼが存在すると、FLEXサイト間の組換えを触媒し、その間のDNAセグメントの向きを変化させることができます。この配向の変化は、遺伝子の初期配置に応じて、遺伝子の活性化または不活性化をもたらします。
「FLEX on」と「FLEX off」とは、Cre-lox FLEXシステムを用いてデザインされた遺伝子コンストラクトの状態を指します。「FLEX on」の状態では、遺伝子やレポーターのような目的の遺伝子要素は、逆方向またはアンチセンス方向に導入されるため、転写は起こりません。しかし、Creを介した組換え後にFLEXサイトが反転するため、活性化または発現されます。逆に、「FLEX off 」状態では、同じ遺伝子要素が活性(発現)状態で導入されますが、Creの導入により、FLEXサイトの新たな配向が転写を妨げるため、不活性化されるか、発現されなくなります。Cre-lox FLEXシステムの双方向かつ可逆的な性質により、研究者は遺伝子の活性化またはサイレンシングを時間的・空間的に正確に制御することができ、条件付きかつ動的な遺伝子発現研究のための強力なツールとなります。「DIO」ベクターと呼ばれるCre-Onベクターは、目的の遺伝子が「Double-floxed with Inverted Orientation」であることを示し、「DO」ベクターとして知られるCre-Offベクターは、目的の遺伝子が「Double-floxed in Orientation」であることを示します(図3)。FLEXスイッチは、様々な科学的目的に応用できる研究ツールとして、研究者に遺伝子発現を不可逆的に正確に制御する強力な手段を提供しています。
このシステムのもう1つの一般的なバリエーションであるCre-Switchは、哺乳類のin vitroおよびin vivoシステムにおいて、Creを介した2つのORFの発現の切り替えを永久的なものにします。FLEX Cre-Switchシステムは、2つの逆平行ORFを挟む2対のloxP変異組換えサイトを採用しており、両方のORFをCre依存的に反転させることにより、一方の遺伝子を活性化し、他方の遺伝子を不活性化することができます。ベクターは異型のloxPバリアント(loxPとlox2272)で設計されており、組換えの特異性を確保しています。両方のloxPバリアントはCreによって認識されますが、loxPサイトまたはlox2272サイトの同一のペアのみが互いに組換え可能であり、他のバリアントとは組換えは起きません。Creが存在しない場合、第一のORFはユーザーが選択したプロモーターの下で発現するが、第二のORFはアンチセンスのためサイレンシングされています。Creが存在すると、組換えによって両方のORFが反転し、その結果、最初のORFがサイレンシングされ、2番目のORFが発現します。
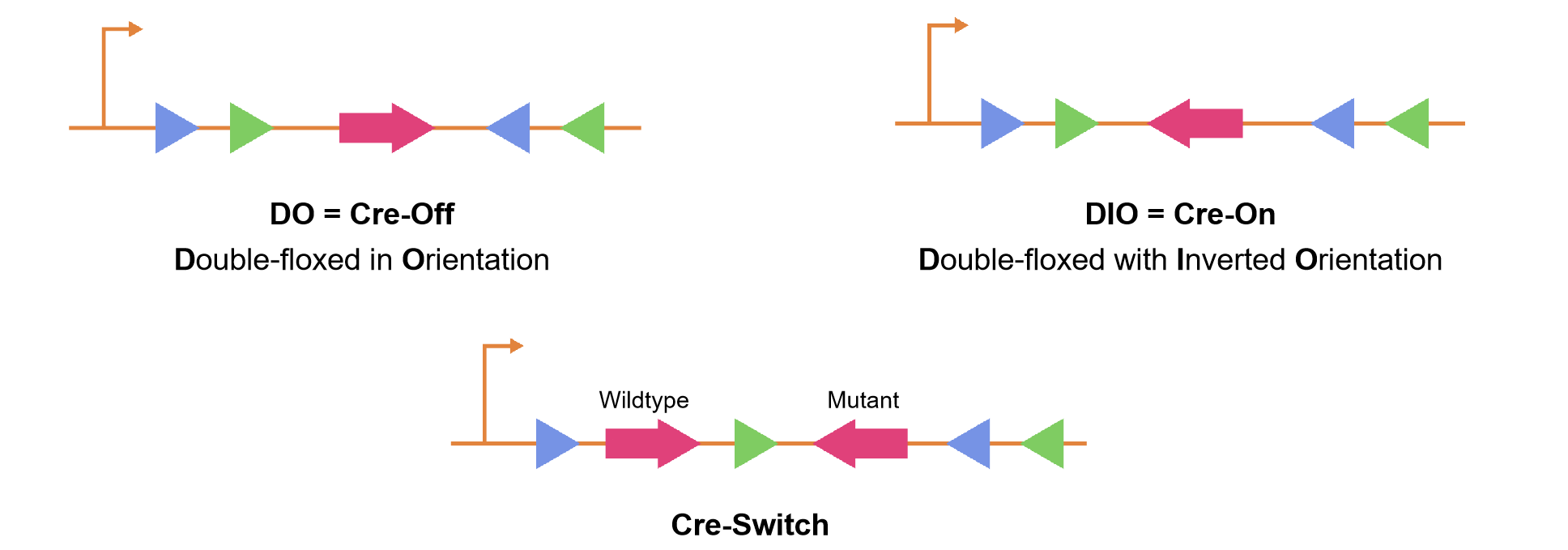
図3. Cre-On, Cre-Off, およびCre-switch における遺伝子とloxpサイトの配置
AAVによるCreのデリバリー
Creリコンビナーゼは、組織特異的プロモーターによって駆動されるアデノ随伴ウイルス(AAV)ベクターを用いて、特定の細胞に選択的に導入することができます。AAVベクターは、その安全性と様々な細胞種への導入効率の高さから、広く採用されています。組織特異的プロモーターをAAVベクターに組み込むことで、Creリコンビナーゼの発現を厳密に制御することができ、特定の細胞型や目的の組織でのみ活性化させることができます。この精密さにより、研究者はCreリコンビナーゼ活性を空間的・時間的に制限された方法で制御することができます。その結果、これらのAAVベクターをトランスジェニックマウスなどの実験対象に投与すると、組織特異的プロモーターによってCreリコンビナーゼが目的の細胞で発現し、標的遺伝子改変が容易になります。このアプローチは、条件付き遺伝子操作を必要とする研究において有用であり、研究者は細胞集団や組織内で高度に特異的かつ制御された形で遺伝子の機能を調べることができます。また、Cre-loxとTet誘導性システムを組み合わせることで、条件付きシステムをより高度に時間制御することも可能であり、Creリコンビナーゼの発現をテトラサイクリン制御プロモーターによって制御することができます。
最近、腫瘍関連マクロファージにおけるTGF-Bの役割を研究するために、Cre-lox技術が応用されました。TGFBI flox/floxマウスが作製され、特定の細胞や組織におけるTGFBI遺伝子をin vivoで欠損させることが可能になりました。細胞特異的な遺伝子操作のために、CD68プロモーターによってマクロファージで特異的にCreを発現させるCre組換えウイルス(AAV8-mCD68-Cre)を構築しました。TGFBI flox/floxマウスにAAV8-mCD68-Creウイルスを投与し、MΦにおけるTGFBIノックアウトを誘導しました。その結果、AAV8-mCD68-Creを注射したTGFBI flox/floxマウスの腫瘍重量は対照群に比べ有意に減少し、TGFBIが腫瘍関連マクロファージの膵がん腫瘍増殖への寄与していることが示唆されました。
結論として、Creリコンビナーゼを導入する手法としてAAVを使用することは、遺伝子工学における強力なツールとなります。AAVを介した送達によって達成される正確さと効率は、特に組織特異的プロモーターと組み合わせた場合に、遺伝子発現の操作において比類ないレベルの制御を可能にします。この技術は、膵臓がん抑制のためにマクロファージ中のTGFBIを標的とする研究で実証されているように、高度に標的化された特異的な遺伝子改変を容易にするAAVの力を示しています。AAVベクターをCre導入に利用する方法は、遺伝子操作の精度を向上させるだけでなく、複雑な生物学的プロセスの研究、革新的な治療戦略の開発、分子レベルでの疾患理解の進展に新たな道を開くものです。
参考文献
Zhou, Jing, et al. "A novel role of TGFBI in macrophage polarization and macrophage-induced pancreatic cancer growth and therapeutic resistance." Cancer letters 578 (2023): 216457.
Schnütgen F, Doerflinger N, Calléja C, Wendling O, Chambon P, Ghyselinck NB. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nat Biotechnol. 2003 May;21(5):562-5. doi: 10.1038/nbt811. Epub 2003 Mar 31. PMID: 12665802.
Lee G, Saito I. Role of nucleotide sequences of loxP spacer region in Cre-mediated recombination. Gene. 1998 Aug 17;216(1):55-65. doi: 10.1016/s0378-1119(98)00325-4. PMID: 9714735.



