SMAを克服する偉業
脊髄性筋萎縮症(SMA)は、脊髄と脳幹の運動ニューロンの喪失を原因とする遺伝性神経筋疾患であり、進行性の筋力低下と萎縮を引き起こします。SMAは、生存運動ニューロン1(SMN1)遺伝子の突然変異によって発症します。SMN1遺伝子は、運動ニューロンの機能に不可欠なSMNタンパク質を産生する役割を担っています。最近、この病気の有力な治療法として異なる作用機序をもつスピンラザとゾルゲンスマという2つの遺伝子治療薬が登場しました。この記事では、遺伝学的な観点からSMAを見つめ、これらの治療法の背後にあるメカニズムについて説明します。
変異の起こりやすいSMN1
SMN1遺伝子はRNAのスプライシングや代謝を含む様々なプロセスに関与するタンパク質をコードしています。ほぼ相同な遺伝子であるSMN2が染色体のセントロメアに~1000kbほど近い位置に存在します。しかし、両者の配列のわずかな違いが重大な機能的な違いを生み出します。2つの遺伝子の重要な違いの一つは、エクソン7のスプライスジャンクションのヌクレオチドにあります。SMN1はエクソン7をmRNAに効率的に取り込むために必要なヌクレオチドを保持しているのに対し、SMN2はmRNAのプロセシング中にエクソン7を優先的に取り除く塩基置換を持ちます。そのため、SMN1は完全長で機能的なタンパク質を産生するが、SMN2は分断された不安定なタンパク質を主に産生することになります。
SMN1遺伝子は欠失や重複などのゲノム変異が起こりやすい、第5染色体の反復配列が多い領域に存在します。このゲノム領域は非常に不安定であるため、SMN1遺伝子の大規模な欠失や近傍遺伝子の重複など、さまざまなタイプの変異が生じる可能性があります。レトロトランスポゾンや他の反復エレメントのような反復配列が存在することによって、SMN1遺伝子座は非相同組換え(NAHR)が起こりやすくなっています。SMN1遺伝子の欠損や重複が生じることによってSMNタンパク質の産生や機能に不具合が起こります。
配列の相同性の高いSMN1とSMN2の間でNAHRが起こるとエクソン7欠失が起こることがあります。これはSMAで最も頻繁にみられる変異です。
スピンラザ
脊髄性筋萎縮症(SMA)の治療薬として2016年に初めてFDAの承認を取得したスピンラザはアンチセンス・オリゴヌクレオチド(ASO)技術であり、SMA治療における重要なマイルストーンとなりました。ASOは、SMN2 pre-mRNAの特定の領域に結合するように設計され、SMN2 RNAスプライシングの過程でエクソン7をインクルードするようにプロセスを変化させます。その結果、より多くのエクソン7を残したmRNA分子が産生され、完全長で機能的なSMNタンパク質の合成が可能になります。これによってSMN1遺伝子の変異や欠失によって引き起こされる欠損を補完します。
スピンラザは、腰椎穿刺法によって患者の脊髄液に直接投与されます。治療は頻繁に投与が行われる導入フェーズと、より少ない治療回数で行う維持フェーズから構成されます。注目すべきことに、スピンラザの第3相臨床試験ではSMAの乳幼児と遅発性SMA患者の両方において、プラセボと比較して運動機能の有意な改善が認められています。そのためにスピンラザは高く評価され、世界中でSMA治療のスタンダードとして採用されています。
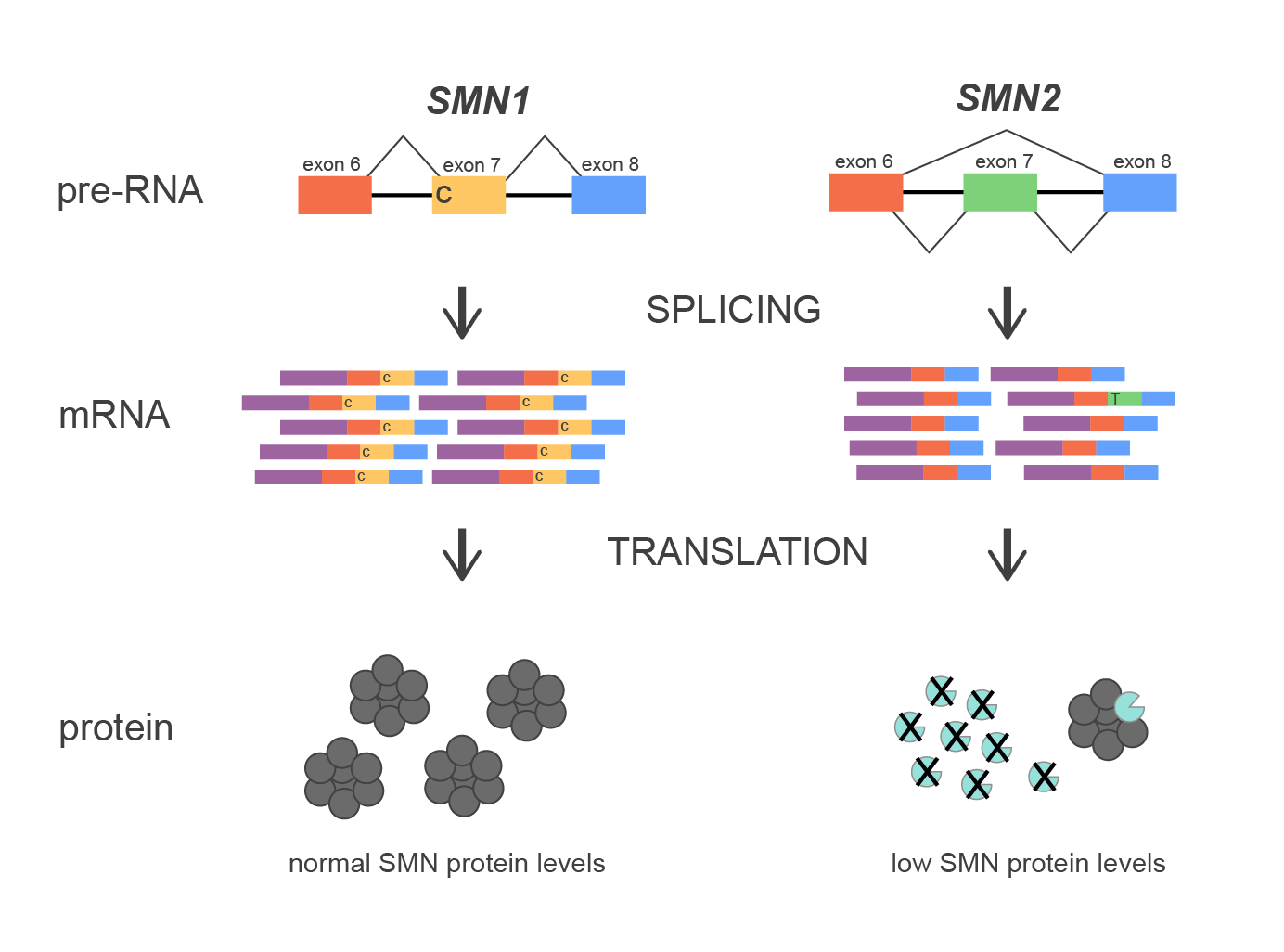
図1.SMN1とSMN2遺伝子のスプライシング機構
ゾルゲンスマ
ゾルゲンスマは、アデノ随伴ウイルス(AAV)ベクターを利用する画期的なSMA遺伝子治療薬です。遺伝子治療として、ゾルゲンスマはSMN1遺伝子の機能的コピーを送達することにより、SMAの根本的な原因を取り除くことを目指しています。
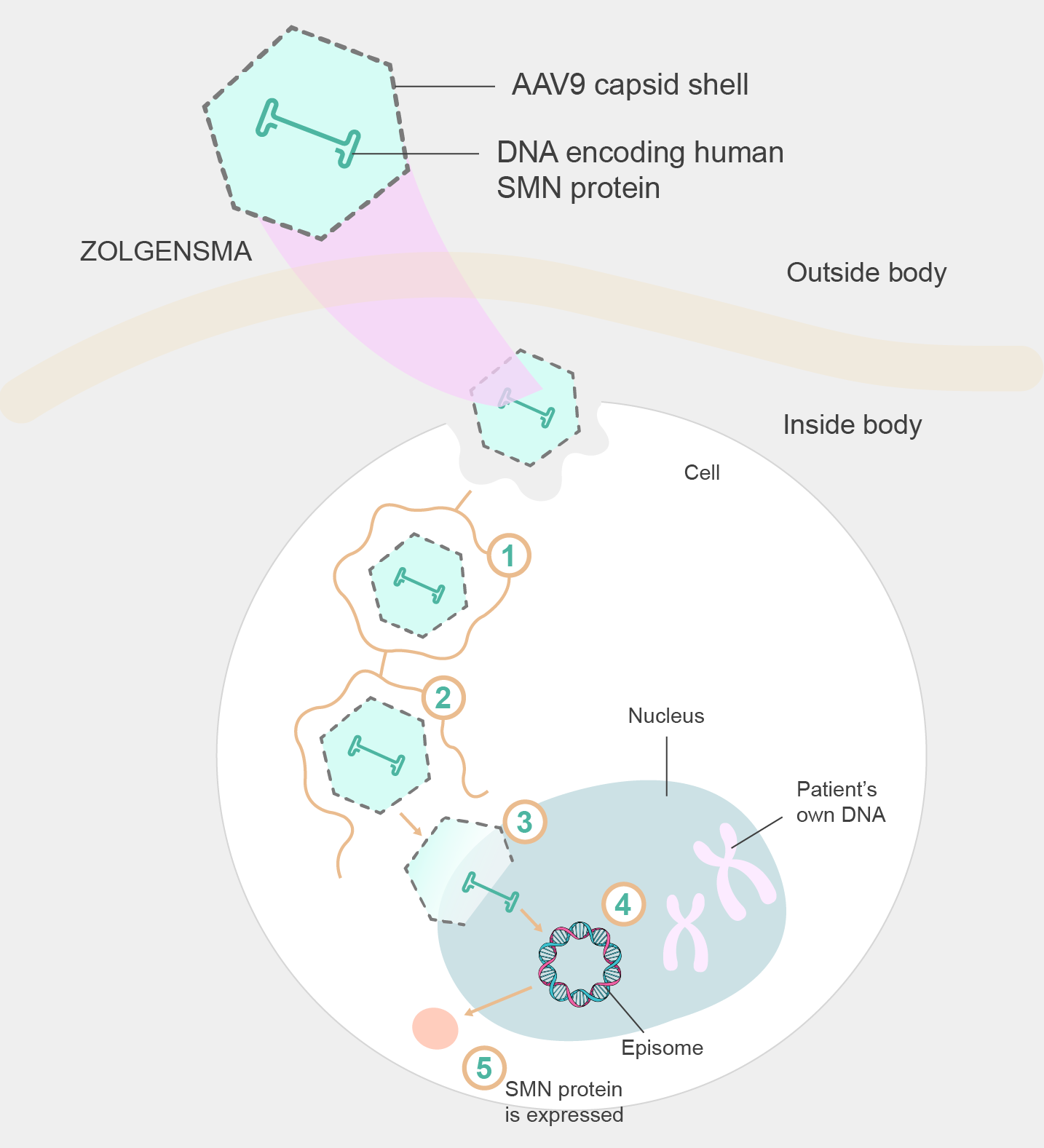
図2.ゾルゲンスマの送達メカニズム
AAV vectors have become a leading choice in gene therapy due to their natural ability to efficiently infect and transfer genetic material into target cells. AAV9 exhibits a preference for crossing the blood-brain barrier and efficiently targeting motor neurons, making it an ideal candidate for delivering the SMN1 gene to the affected cells in SMA patients. The AAV9 capsid, the protein shell that encapsulates the viral genome, protects the therapeutic cargo during delivery and aids in cellular entry and transduction.
By utilizing AAV9 as the vector for Zolgensma, the therapy aims to restore SMN protein levels in motor neurons, thereby preventing further degeneration and improving motor function in patients with SMA. The AAV9 vector delivers the functional SMN1 gene directly into the target cells, where it initiates the production of the SMN protein. This mechanism allows Zolgensma to address the root cause of SMA at the genetic level, potentially offering long-term therapeutic benefits. The choice of AAV9 as the vector for Zolgensma reflects a strategic selection based on its ability to target motor neurons efficiently and specifically, making it a critical component of the therapy's success in treating SMA.
AAVベクターは標的細胞に効率的に感染して遺伝物質を送達できる能力により、遺伝子治療における主要な選択肢となっています。AAV9は血液脳関門を通過して効率的に運動ニューロンをターゲッティングすることができ、SMA患者の患部にSMN1遺伝子を送達するための理想的なツールです。AAV9カプシドはウイルスゲノムをカプセル化するタンパク質であり、送達中の治療用遺伝子を保護と細胞への侵入、伝達に必要です。
ゾルゲンスマはAAV9を利用して運動ニューロンのSMNタンパク質レベルを回復させることで、SMA患者のもつSMNタンパク質の変性を防ぎ、運動機能を改善することを目指しています。ゾルゲンスマのAAV9ベクターは標的細胞に機能的なSMN1遺伝子を直接送り込み、SMNタンパク質の産生を促します。これによって、ゾルゲンスマはSMAの根本原因を遺伝子レベルで解決し、長期的な治療効果をもたらす可能性があります。ゾルゲンスマにAAV9が選択された理由は、AAV9が運動ニューロンを効率的かつ特異的に標的にする能力を持つための戦略的な選択であり、SMA治療の成功に不可欠です。
ゾルゲンスマは患者に静脈注射で1回のみ投与されます。患者の体重によって投与量は決定され、数時間かかることもある投与時間のあいだ、患者に副作用がないかがモニターされます。AAVベクターの性質上、ニューロンにおけるSMN1の発現は数日から数週間検出されないこともあり得ます。ゾルゲンスマのフェーズ1、フェーズ2、フェーズ3臨床試験は一貫して有望な結果を出しています。SMAタイプ1型の乳児を対象とした小規模な臨床試験であるフェーズ1では、ゾルゲンスマの生存率と運動機能の数値が急速に向上し、一部の乳児は自分の力で座ることができるようになりました。フェーズ2では明らかな運動機能の持続的改善と疾患進行の遅延がみられ、フェーズ1の知見が確認されました。フェーズ3ではゾルゲンスマを投与した乳児は運動技能が劇的に向上し、多くの乳児が支えがなくても座れるようになりました。
治療法の比較
ゾルゲンスマはSMAの遺伝的原因に対処するため、1回限りの点滴静注によりSMN1遺伝子の機能的コピーを運動ニューロンに導入します。一方、スピンラザはアンチセンスオリゴヌクレオチドを脊髄注射で定期的に投与することが必要で、SMN2遺伝子のスプライシングを改変してSMNタンパク質の産生を増加させて機能的なSMN1遺伝子を補完します。コスト面でゾルゲンスマとスピンラザには大きな違いがあります。ゾルゲンスマは1回限りの遺伝子治療ですが、高い初期費用が必要です。一方、スピンラザは一回の治療費としては比較的安価ですが定期的な投与が必要なため、時間の経過とともに総費用が蓄積していきます。
スピンラザとゾルゲンスマは異なる副作用と毒性があります。アンチセンスオリゴヌクレオチドであるスピンラザは注射部位の疼痛、不快感、処置に伴う合併症の潜在的リスクなど、繰り返し脊髄注射をすることから起こる副作用の可能性があります。一方、遺伝子治療薬であるゾルゲンスマは臨床試験においておおむね良好な安全性プロファイルを示していますが、遺伝子導入に使用されるウイルスベクターに対する免疫反応のリスクがあるため、慎重なモニタリングと管理が必要でとなります。
臨床医がSMA患者に対してスピンラザとゾルゲンスマのどちらを使うかを決めるときには、いくつかの要素を考慮することになります。SMAタイプや病状の進行度合いによって有効性に違いがでる可能性があるので、SMAの症状や患者の年齢及び健康状態を考慮に入れます。症状の重いSMAの乳幼児にとって、1回限りのゾルゲンスマの遺伝子治療は迅速な運動機能の改善と発育の点から、魅力的な選択肢となります。しかし、高齢のSMA患者や重症度の低いSMA患者には有効性と安全性が確立されているSpinrazaの方が適しているかもしれません。加えて治療法の利用可能性、保険の適用範囲、患者個人の希望なども考慮されます。最終的には、専門知識をもった臨床医が患者固有の状況を十分に理解することが、最も適切で個別化された治療法の上で重要な役割を果たします。
脊髄性筋萎縮症(SMA)はSMN1遺伝子の変異によって引き起こされる、運動ニューロンの消失を特徴とする複雑な遺伝性神経筋疾患です。スピンラザとゾルゲンスマという2つの著名な治療法の開発は、SMA患者に新たな希望をもたらしました。スピンラザとゾルゲンスマは、SMA治療における大きな進歩であり、この難病を克服するための新たな道を提供しました。さらなる研究と進行中の臨床研究によりSMA治療法が改良・最適化されれば、SMA患者の症状の改善と生活の質がさらに改善されていくでしょう。
参考文献
Fischell JM, Fishman PS. A Multifaceted Approach to Optimizing AAV Delivery to the Brain for the Treatment of Neurodegenerative Diseases. Front Neurosci. 2021 Sep 24;15:747726. doi: 10.3389/fnins.2021.747726. PMID: 34630029; PMCID: PMC8497810.
https://www.spinraza.com/en_us/home/why-spinraza/how-spinraza-works.html?cid=PPC-GOOGLE-Branded_Zolgensma_Exact_Tier+1~S~PH~BR~NER~DTC~COM-zolgensma-NA-p74193523522&gclid=EAIaIQobChMIhsCT3YaKgAMVmOqUCR1C2w3bEAAYASAAEgL8cvD_BwE&gclsrc=aw.ds



