CRISPRによる臨床CAR-T治療効率の向上
CAR-T細胞療法は、がん治療における現実的な選択肢になりつつあり、この分野における技術革新は急速に進んでいます。この治療法は患者から採取された免疫細胞に再プログラミングを施します。従来の化学療法とは異なり、再プログラミングした免疫細胞を投与することで、浸潤がん細胞を特異的に破壊することができます。ここではCAR-T細胞ベクターの基本的な生物学を掘り下げ、臨床で使用されているCAR-T細胞療法を紹介していきます。また、CRISPR/Cas9が次世代CAR治療薬開発にどのように利用されているかについても詳しく述べていきます。
CAR-T細胞療法
CAR-T療法と略される、キメラ抗原受容体(CAR)を発現するT細胞を利用する治療法は、がん治療分野における免疫療法の革命です。この革新的な治療法は、免疫システムに重要な白血球の一種である患者自身のT細胞を遺伝子改変し、そのT細胞表面にCARを発現させます。CARはがん細胞表面にあるユニークなマーカーもしくは抗原を特異的に認識して標的とするように設計されます。これらのCAR-T細胞が患者の血流に投与されると、CAR-T細胞は強力な戦士となり、驚くべき精度でがん細胞を追跡し、強力な攻撃を開始します。CAR-T療法は免疫系がもつ本来の能力を活用してがんと闘うことができること証明し、複数タイプのがん治療において目覚ましい成功を収めることによって、これまで治療法が限られていた患者達に新たな希望を与えています。
CAR-T治療の成否は免疫治療のためにどのような人工受容体をデザインするのかに依存しています。CARは主に3つのコンポーネントから構成され1)抗体由来の一本鎖可変フラグメント(scFv)が使用される、がん細胞上の標的抗原に特異的に結合する細胞外抗原認識ドメイン、2)CARを細胞膜に局在させる膜貫通ドメイン、3)T細胞受容体複合体のCD3ζ由来の細胞内シグナル伝達ドメイン、CD28や4-1BBのような複数の共刺激ドメインも併せて使用される。このユニークな構造によってCAR-T細胞は主要組織適合性複合体(MHC)とは無関係にがん細胞を認識し標的とすることができ、がん組織に対する細胞傷害活性の活性化を可能にしています。
MHCとは無関係に標的がん細胞を攻撃できることは、CAR療法において重要な利点となります。一部のがん細胞はMHCの発現を低下もしくは変化させたりすることで、MHC分子による抗原断片の提示に依存する従来の免疫応答システムを回避します。CAR-T細胞は、MHC提示を必要としないで表面抗原を直接認識するように設計されています。そのため、CAR-T細胞は、免疫システム監視から隠れてしまうがん細胞を効果的に標的にできます。がん組織内の個々の細胞が異なるMHC発現レベルを示す可能性があるため、CARの持つ特性は不均一ながん組織と戦うために重要な意味を持ちます。
CAR-T細胞療法は特異性が高く、オフターゲットの可能性も減らすことができます。がん細胞上の特定の表面抗原を正確に認識することにより、CAR-T細胞は健康な細胞を攻撃するリスクを最小限に抑えます。高い認識精度は、MHCよるT細胞認識を利用した従来の免疫療法によく見られた重篤な副作用を避ける上で特に重要です。まとめると、CAR-T細胞療法にとってMHC非依存的にがん細胞を標的にできる能力はがんの免疫回避戦略を克服するとともに、特異性を維持しながら広範囲のがんに対応できる、汎用性の高い標準的治療法の提供を可能にします。
キムリア(チサゲンレクルユーセル)
チサゲンレクルユーセルとして知られるキムリアは、ノバルティス社が開発したCAR-T細胞療法です。再発または難治性のB細胞性急性リンパ芽球性白血病(ALL)の小児および若年成人患者を治療するために設計されましたが、成人びまん性大細胞型B細胞リンパ腫(DLBCL)および成人濾胞性リンパ腫(FL)の患者にも使用が拡大されています。キムリアの治療プロセスは、まず患者の血液のアフェレーシスによってT細胞を含む血漿を除去し、その後血液を再投与することから始まります。アフェレーシス後の細胞は凍結保存されて製造施設に送られます。
患者の細胞は免疫活性化磁気ビーズとの培養後、レンチウイルスベクターが投与されます。このレンチウイルスベクターは、遺伝子発現カセットを細胞のゲノムに永久的に組み込みます。この発現カセットはいくつかのコンポーネントから構成されるCAR遺伝子を持ちます。このCARは、がん性B細胞の表面に大量に存在する特異的抗原であるCD19を認識するように設計された細胞外認識ドメイン、CARをT細胞膜に固定して構造的安定性をもたらす膜貫通ドメイン、抗原結合時に活性化してT細胞の活性化とそれに続く標的がん細胞の破壊をもたらす細胞内シグナル伝達ドメインを持ちます。カムリアのがん治療はこの複雑プロセスによって達成されており、生体本来の免疫システムを活用した白血病やリンパ腫の有望な治療法となっています。

図1.キムリアのキメラ抗原受容体の模式図
キムリアの臨床試験では、特に再発/難治性の小児および若年成人患者のすべてにおいて非常に有望な結果が得られています。キムリアは臨床試験において完全寛解を含む完全奏効率(ORR)82%という素晴らしい結果を示しました。5年無再発生存率は49%に達し、無病期間の延長と持続的な奏効を示しています。同様に、再発/難治性のDLBCLおよびFL患者において、キムリアはそれぞれ53%および86%のORRを示し、これらの血液悪性腫瘍治療の困難に直面している患者に新たな希望を与えています。
CRISPRによるCAR治療法の改良
CAR-T療法の開発は進んでいますが、依然としてCAR-T細胞の製造と生体内での持続性という問題が存在しています。CAR-T細胞の増殖と持続性に問題があると、治療が失敗する恐れがあります。また、患者由来のT細胞の収集の問題や望ましくない腫瘍内微小環境(特に固形腫瘍)の問題が治療効果を妨げています。CRISPR/Cas9遺伝子編集技術によるCAR-T細胞療法の強化によって、これらの問題の解決が試みられています。
CRISPR/Cas9遺伝子編集技術は任意のゲノム箇所に2本鎖DNA切断を作り出すことによって正確な遺伝子編集を実現できます。CRISPR/Cas9の様々な応用法によって、T細胞機能の向上、毒性の軽減、利用幅の拡大などのCAR T細胞療法を強化することができます。
一つの大きな問題は、腫瘍抗原に長期間さらされるとT細胞の機能が失われるT細胞の疲弊化です。CRISPR/Cas9はPD-1やCTLA-4などの阻害性レセプターを標的とすることで、この疲弊を克服してCAR-T細胞を若返らせ、治療効果を高めることができる可能性を提供します。
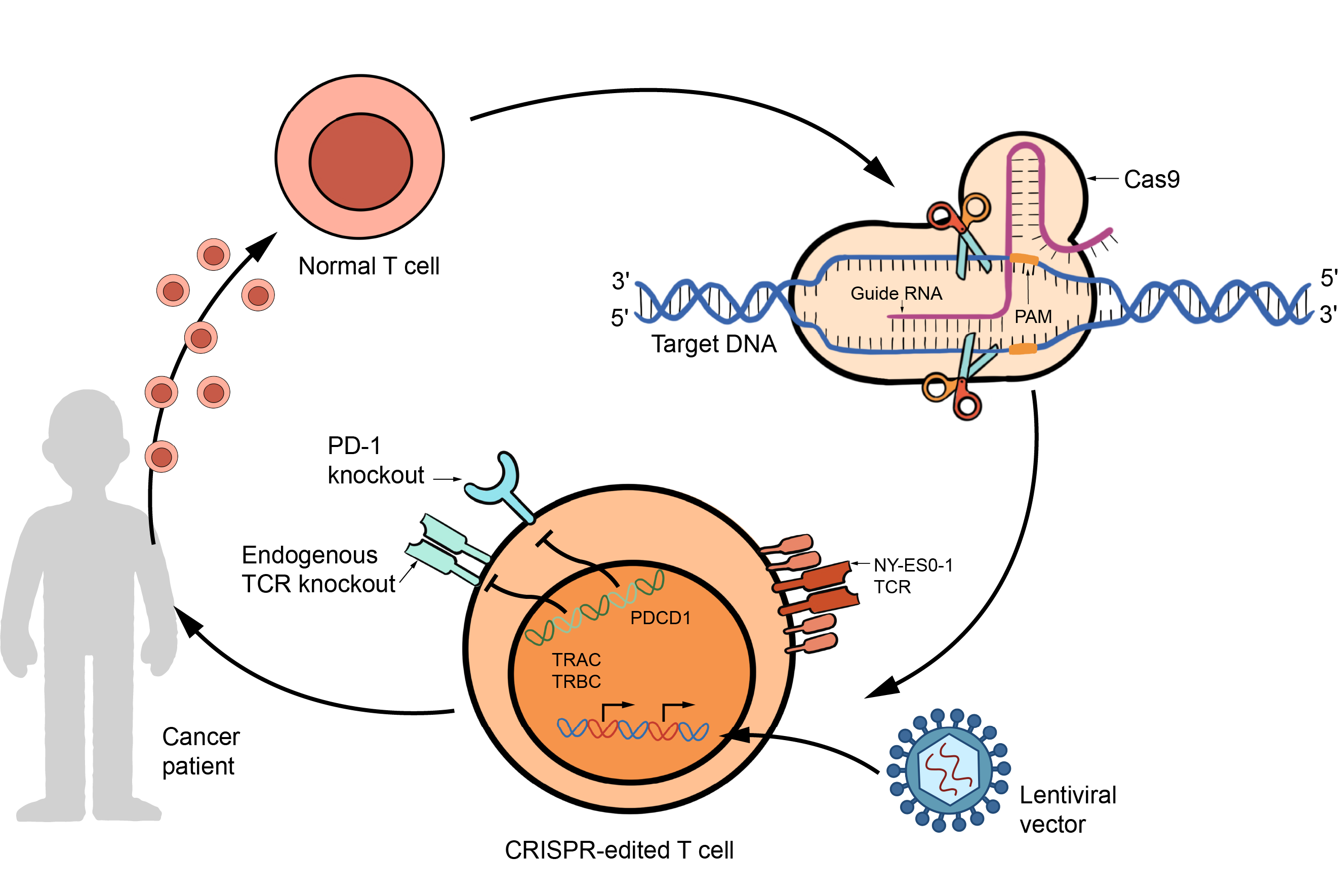
図2. CAR-T細胞におけるCRISPR/Cas9技術の使用。
さらにCRISPR-Cas9によってCAR-T細胞の機能と安全性を最適化できます。サイトカインシグナル伝達を調節することで、CRISPR-Cas9はCAR-T細胞の活性化と増殖を細やかに調整して毒性の副作用を軽減しながら抗腫瘍活性を強化できます。また、特定のゲノム位置にCAR導入遺伝子を正確に組み込むことによって、安定して制御されたCAR発現を達成します。これによってCAR-T細胞の機能と持続性を損なう可能性のあるトニックシグナルのリスクを低減できます。
さらに、CRISPR-Cas9は"既製品としての"普遍的なCAR-T細胞製品の作成を可能にして、CAR-T細胞療法の生産に革命をもたらしました。健康なドナーT細胞を使用した同種T細胞療法は、CRISPR-Cas9によって宿主免疫細胞による拒絶反応に抵抗できるように改変されています。製造プロセスを簡素化することで、CAR-T細胞療法はより費用対効果が高く、利用しやすくなります。
CAR-T細胞療法はがんとの闘いにおける強力なツールとして登場し、さまざまながん治療において素晴らしい有効性を示しています。キムリアの成功は、患者の免疫系を利用してがん細胞を正確に攻撃する方法の有効性を証明しました。さらにCRISPR/Cas9は、CAR-T療法の有効性をさらに高める可能性を秘めています。CRISPR/Cas9はT細胞の疲弊、製造効率、in vivoでの持続性といった課題を解決して、さらに大きな可能性を引き出す道筋を提供しています。CAR-T細胞療法がより安価で利用しやすく、効果的で適応性が高くなれば、がん克服に近づくことができ、世界中の患者に新たな希望を届けることができます。
参考文献
Dimitri, A., Herbst, F. & Fraietta, J.A. Engineering the next-generation of CAR T-cells with CRISPR-Cas9 gene editing. Mol Cancer 21, 78 (2022). https://doi.org/10.1186/s12943-022-01559-z
Awasthi R, Maier HJ, Zhang J, Lim S. Kymriah® (tisagenlecleucel) - An overview of the clinical development journey of the first approved CAR-T therapy. Hum Vaccin Immunother. 2023 Dec 31;19(1):2210046. doi: 10.1080/21645515.2023.2210046. Epub 2023 May 15. PMID: 37185251; PMCID: PMC10294746.



